CO-biosyntese påkrævet til samling af det aktive sted i NiFe-hydrogenase
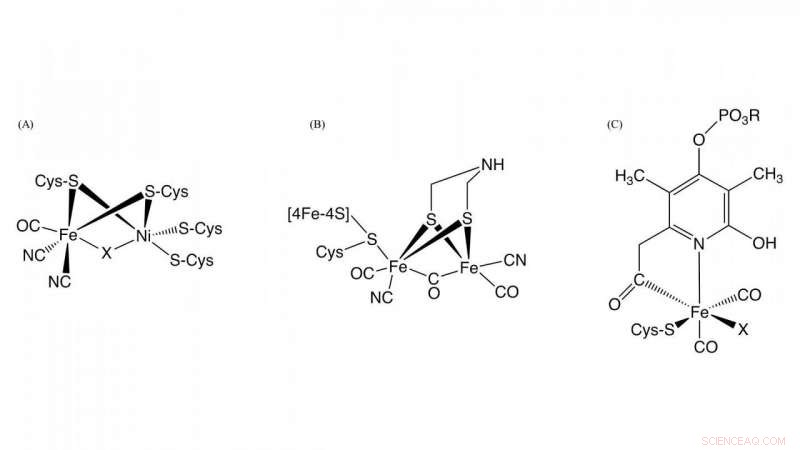
Figur 1. Struktur af de aktive steder i [NiFe] -hydrogenase, [FeFe] -hydrogenase, og [Fe] -hydrogenase Kredit:NINS/IMS
En forskergruppe, der omfatter forskere fra Exploratory Research Center on Life and Living Systems (ExCELLS), Institute for Molecular Science (IMS) i National Institutes of Natural Sciences, og Osaka University har afsløret den detaljerede mekanisme for biosyntesen af kulilte, der er afgørende for modning af det aktive sted af NiFe-hydrogenase.
Hydrogenase, som er et metalloenzym, der er ansvarligt for oxidation af hydrogengas og reduktion af protoner, spiller en central rolle i bakteriel brintmetabolisme. Baseret på forskellene i metalindhold på det aktive sted, de er klassificeret i tre grupper:NiFe-, FeFe-, og Fe-hydrogenaser indeholdende forskellige metalkomplekser som aktive centre i disse enzymer (figur 1). Selvom strukturerne i de aktive centre i dem er forskellige, det er afgørende for hydrogenaseaktivitet, at kulilte (CO) koordineres med jernionen i det aktive center. Det vides, at CO biosyntetiseres ved en enzymatisk reaktion, men detaljerne i CO -biosyntese var ukendte.
I denne forskning, gruppen bestemte krystallstrukturen af enzymet (HypX), der er ansvarlig for biosyntesen af CO (figur 2), baseret på hvilken HypX biosyntetiserer CO ved en hidtil uset reaktion for modning af NiFe-hydrogenase. HypX består af to domæner:N-terminal og C-terminal domæner. Et kontinuerligt hulrum, der forbinder N- og C-terminaldomæner, er til stede i det indre af HypX (figur 2). I krystalstrukturen, coenzym A (CoA) er bundet til den C-terminale region i hulrummet.
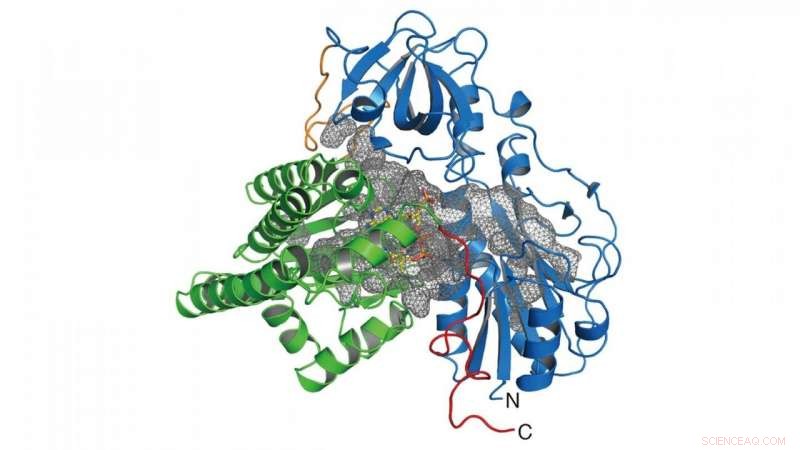
Figur 2. Krystalstruktur for HypX. N- og C-terminale domæner er vist med blå og grøn, henholdsvis. Hulrummet inde i HypX er vist i et gråt net. Kredit:NINS/IMS
To forskellige reaktioner forekommer i de N- og C-terminale domæner. I N-terminal domænet, en formylgruppeoverførselsreaktion fra formyltetrahydrofolat, som er bundet i det N-terminale område af hulrummet som et substrat for CoA, finder sted (reaktionstrin 1 i fig. 3). På dette tidspunkt, CoA i hulrummet vedtager den lineære udvidede konformation, og SH-gruppen af CoA er placeret nær formylgruppen i formyltetrahydrofolatet bundet i det N-terminale domæne. Derefter, formyl-CoA fremstilles som et reaktionsmellemprodukt ved formyl-gruppeoverførselsreaktionen fra formyltetrahydrofolat til CoA.
I det næste trin, formyl-CoA undergår en stor konformationsændring i hulrummet, så formylgruppen i formyl-CoAs endelige position er placeret på det aktive sted i det C-terminale domæne i HypX (reaktionstrin 2 i fig. 3). I C-terminal domænet, CO dannes ved decarbonylering af formyl-CoA (reaktionstrin 3 i fig. 3).
Denne CO -biosyntesereaktion er en hidtil uset og ny reaktion. CoA er kendt som et coenzym, som har den vigtige rolle i fedtsyremetabolisme og cellulær energisk metabolisme gennem citronsyrecyklussen. Imidlertid, det er aldrig blevet rapporteret, at CoA/formyl-CoA er involveret i CO-biosyntesereaktioner. Denne forskning har afsløret en ny fysiologisk funktion af et velkendt coenzym CoA.
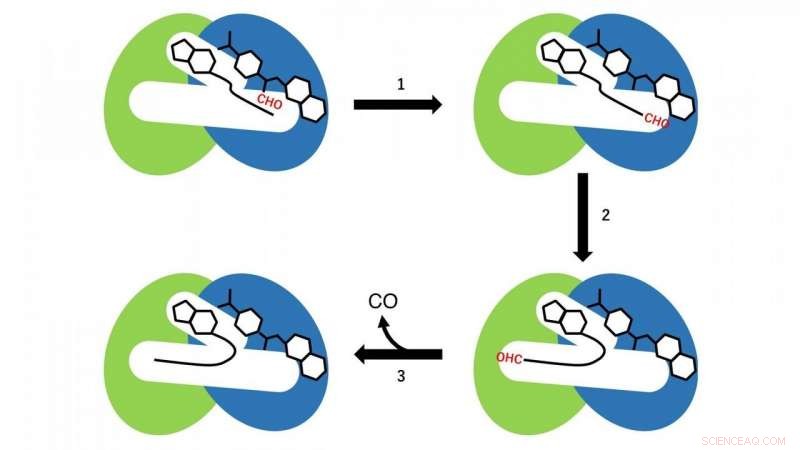
Figur 3. Reaktionsskema for CO-biosyntese ved HypX. N- og C-terminale domæner er vist i henholdsvis blå og grøn. Formylgruppe (CHO) er vist med rødt. Kredit:NINS/IMS
Fremtidsudsigter:
De biosyntetiske mekanismer for metalloenzymer forbliver ukendte i mange tilfælde. Det mangler at blive belyst, især hvordan de metalholdige aktive centre af metalloenzymer er blevet samlet. I dette arbejde, vi bestemte den første krystalstruktur af enzymet, der katalyserer den biosyntetiske reaktion af kulilte, der er afgørende for konstruktionen af det aktive sted for [NiFe] hydrogenase. I fremtiden, vi vil fortsætte forskningen for at belyse den detaljerede mekanisme for hele hydrogenasemodningsvejen baseret på dette resultat.
 Varme artikler
Varme artikler
-
 Identifikation af designermedicin taget af overdosispatienterLægemidler frigivet fra testpatronen (i midten) identificeres af et massespektrometer (venstre). Kredit:Greta Ren Overdosering af stoffer tager en enorm vejafgift på folkesundheden, med potente sy
Identifikation af designermedicin taget af overdosispatienterLægemidler frigivet fra testpatronen (i midten) identificeres af et massespektrometer (venstre). Kredit:Greta Ren Overdosering af stoffer tager en enorm vejafgift på folkesundheden, med potente sy -
 Hvad er den kemiske formel af stål?Når nogle mennesker tænker på stål, kan de forestille sig, at en skyskraber samles ved hjælp af massive nitte bjælker, mens andre mennesker kan forestille sig kroppen og motoren i en klassisk bil på e
Hvad er den kemiske formel af stål?Når nogle mennesker tænker på stål, kan de forestille sig, at en skyskraber samles ved hjælp af massive nitte bjælker, mens andre mennesker kan forestille sig kroppen og motoren i en klassisk bil på e -
 Bygninger i menneskelig knogle kan være nøglen til stærkere 3-D-printede letvægtsstrukturerIngeniører designede et materiale med samme mængde stav- og pladelignende strukturer som menneskelige trabekler og arrangerede dem i et periodisk mønster, præsenterer en ny måde at styrke lette 3D-pri
Bygninger i menneskelig knogle kan være nøglen til stærkere 3-D-printede letvægtsstrukturerIngeniører designede et materiale med samme mængde stav- og pladelignende strukturer som menneskelige trabekler og arrangerede dem i et periodisk mønster, præsenterer en ny måde at styrke lette 3D-pri -
 Forskning i edderkoppelim løser klæbrige problemerEn orb edderkop, ekstraordinær limmaskine, på arbejde på et web. Kredit:University of Akron Har du nogensinde spekuleret på, hvorfor maling skræller af væggen under sommerens høje luftfugtighed? D
Forskning i edderkoppelim løser klæbrige problemerEn orb edderkop, ekstraordinær limmaskine, på arbejde på et web. Kredit:University of Akron Har du nogensinde spekuleret på, hvorfor maling skræller af væggen under sommerens høje luftfugtighed? D
- Menneskelige befolkninger overlevede Toba vulkanske superudbrud 74, 000 år siden
- Video:Hvordan tåregas påvirker din krop
- Ser assembly i nanoskala live
- Om geometrien af en fem-punkts stjerne
- Pantry ingredienser kan hjælpe med at dyrke kulstof nanorør
- Google Assistant til at læse websider højt på nogle enheder


