Ser assembly i nanoskala live
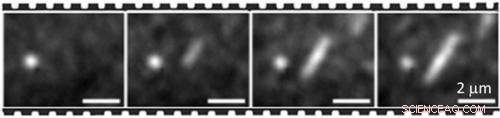
En forkortet time-lapse-sekvens af fluorescerende mikrofotografier, der viser et voksende proteinfilament (i midten), med det lyse runde tilslag (venstre) brugt som referencepunkt
Ebola virus, Alzheimers amyloid fibriller, vævskollagenstilladser og cellulært cytoskelet er alle filamentøse strukturer, der spontant samles fra individuelle proteiner.
Mange proteinfilamenter er godt undersøgt og finder allerede anvendelse i regenerativ medicin, molekylær elektronik og diagnostik. Imidlertid, selve processen med deres samling - proteinfibrillogenese - forbliver stort set uafsløret.
En bedre forståelse af denne proces gennem direkte observation forventes at tilbyde nye applikationer inden for biomedicin og nanoteknologi og samtidig levere effektive løsninger til patogendetektion og molekylær terapi. Dannelsen af proteinfilamenter er meget dynamisk og sker over tid og længdeskalaer, der kræver hurtige målinger med nano-til-mikrometer præcision. Selvom mange metoder kan opfylde disse kriterier, er forbeholdet at måle i vand og i realtid. Udfordringen forstærkes af behovet for at have en homogen samling karakteriseret ved ensartede væksthastigheder af filamenter af ensartet størrelse.
For at tackle denne udfordring, et NPL-hold udtænkte en arketypisk fibrillogenese-model baseret på et kunstigt protein, hvis samling blev optaget i realtid ved hjælp af superopløsningsmikroskopi. Resultaterne er offentliggjort i Nature Publishing Group's Videnskabelige rapporter .
Angelo Bella, Higher Research Scientist i NPL's Biotechnology Group forklarer:"Ved at være i stand til kontinuerligt at afbilde samlingen fra start til modning har vi fastslået, at proteinmonomerer rekrutterer i begge ender af voksende filamenter med ensartede hastigheder på en meget samarbejdsvillig måde."
Undersøgelsen giver et målegrundlag for at studere forskellige makromolekylære samlinger i realtid og lover at udvikle tilpassede nano-til-mikroskala strukturer in situ.
 Varme artikler
Varme artikler
-
 Bøjning af diamant er muligt, på nanoskalaenKredit:Flickr/Kim Alaniz Diamant er værdsat af både videnskabsmænd og juvelerer, hovedsagelig for en række ekstraordinære egenskaber, herunder enestående hårdhed. Nu har et hold australske forsker
Bøjning af diamant er muligt, på nanoskalaenKredit:Flickr/Kim Alaniz Diamant er værdsat af både videnskabsmænd og juvelerer, hovedsagelig for en række ekstraordinære egenskaber, herunder enestående hårdhed. Nu har et hold australske forsker -
 Forskere forestiller nanopartikler i aktionDeborah Kelly. (Phys.org) — De makroskopiske virkninger af visse nanopartikler på menneskers sundhed har længe været tydelige for det blotte øje. Hvad forskerne har manglet, er evnen til at se de
Forskere forestiller nanopartikler i aktionDeborah Kelly. (Phys.org) — De makroskopiske virkninger af visse nanopartikler på menneskers sundhed har længe været tydelige for det blotte øje. Hvad forskerne har manglet, er evnen til at se de -
 Mere effektiv omdannelse af varme til elektricitet ved at pille ved nanostrukturEt grafisk sammendrag af forskningen. Kredit:Delft University of Technology Termoelektriske materialer omdanner varme til elektricitet, hvilket gør dem yderst attraktive for bæredygtig energiprodu
Mere effektiv omdannelse af varme til elektricitet ved at pille ved nanostrukturEt grafisk sammendrag af forskningen. Kredit:Delft University of Technology Termoelektriske materialer omdanner varme til elektricitet, hvilket gør dem yderst attraktive for bæredygtig energiprodu -
 En ny teori for halvledere lavet af nanokrystallerTætpakkede krystaller i en nanokrystalhalvleder:modellen udviklet af ETH-forskere beskriver hvert enkelt atom. Kredit:ETH Zürich / Nature Communications Forskere ved ETH har givet den første teore
En ny teori for halvledere lavet af nanokrystallerTætpakkede krystaller i en nanokrystalhalvleder:modellen udviklet af ETH-forskere beskriver hvert enkelt atom. Kredit:ETH Zürich / Nature Communications Forskere ved ETH har givet den første teore
- NASA-rover forsøger det hidtil sværeste Mars-touchdown
- Forholdet mellem masse, volumen og densitet
- Hvordan man bygger et perfekt sprog
- Forskere knækker opløsningsmiddelblandinger puslespil
- Onsala Twin Telescopes klar til verden
- Flyvende biler kan reducere emissionerne, udskifte fly, og frigør veje – men ikke hurtigt nok


