Forskere knækker opløsningsmiddelblandinger puslespil
Kredit:HIMS
Kemikere, der arbejder ved University of Amsterdams (UvA) forskningsprioritetsområde for bæredygtig kemi, har samarbejdet med Solvay Lab of the Future i Bordeaux om at udvikle en praktisk værktøjskasse til at forudsige opløseligheden af små molekyler i forskellige opløsningsmidler. Disse værktøjer er tilgængelige fri adgang og gratis, og kan forbedre opløsningsmiddelvalg og formuleringer af mange industrielle produkter.
Opløsningsmidler er ekstremt vigtige for mange industrisektorer. Tit, i formuleringen af et kemisk produkt udgør opløsningsmidlet størstedelen af enheden. Det er også afgørende for produktets funktion. For eksempel, med den rigtige opløsningsmiddelformulering, pesticider bliver længere på bladene efter regn, maling og blæk tørrer hurtigere, og kosmetik påføres lettere. Kendskab til molekylers opløselighed er derfor afgørende for produktudvikling.
Problemet med små molekyler
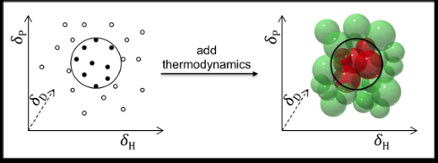
Forudsigelsen af opløselighed udføres normalt ved hjælp af de såkaldte Hansen Solubility Parameters:dispersion (D), polære interaktioner (P), og hydrogenbinding (H). Belægnings- og polymerindustrien, for eksempel, opnår fremragende resultater ved at bruge disse parametre til at forudsige opløseligheden af polymerer.
I princippet, Hansen-parametre kan også bruges til at finde opløsningsmidler til mindre molekyler som medicin og kosmetik. Men der er forudsigelserne ikke så tilfredsstillende, af to grunde:En, fordi lægemidler og kosmetik typisk har mere varierede funktionelle grupper; og to, fordi de oprindelige Hansen-parametre udelukker termodynamiske overvejelser vedrørende blanding, smeltning og opløsning. Dette er acceptabelt for polymerer (hvor termodynamikken annulleres), men ikke for små molekyler.
Dr. Manuel Louwerse og Prof. Gadi Rothenberg, arbejder sammen med Dr. Bernard Roux team hos Solvay, har nu forbedret Hansens model og tilpasset den til at håndtere opløste stoffer med små molekyler ved at inkludere blandingens termodynamik, smeltning og opløsning. Forbedringerne er baseret på en bedre beskrivelse af både entropi- og entalpi-leddet. Når en forbindelse opløses, molekyler forlader krystallen og blander sig i opløsningsmidlet. Dette øger entropien, men koster normalt noget entalpi. Det centrale spørgsmål her er, at mængden af entropi opnået ved blanding bestemmer, hvor meget entalpi der kan gå tabt, mens der holdes en negativ ∆G (med andre ord, opretholdelse af drivkraften for opløsningen). Da entropieffekten afhænger af koncentrationen, temperaturen, og størrelsen af molekylerne, disse bør alle medtages.
En anden forbedring blev foretaget ved at opdele bidragene fra elektrondonorer og acceptorer mellem opløsningsmidlet og det opløste stof. Dette er især vigtigt for tilfælde som hydrogenbinding, som er relevant for mange opløsningsmidler og opløste stoffer. Mantraet 'som opløser som' er for forsimplet her. Hydrogenbindinger dannes mellem donorer og acceptorer, så man har brug for donorer til at opløse acceptorer, og omvendt. Ved at opdele donor- og acceptorbidragene for hvert opløsningsmiddel og opløst stof, UvA-teamet fik mere præcise modeller.
De nye modeller er meget bedre til at forudsige små molekylers opløselighed i opløsningsmidler og opløsningsmiddelblandinger. Tests på et stort industrielt datasæt med 15 forskellige opløste stoffer og 48 opløsningsmidler og deres blandinger på Solvay Lab of the Future viste, at pasformen blev forbedret fra 0,89 til 0,97. Procentdelen af korrekte forudsigelser steg fra 54 % til 78 %. Da bare gæt allerede ville give 50 % korrekte forudsigelser, dette er en alvorlig forbedring. En anden vigtig fordel er, at den nye model muliggør forudsigelser ved ekstrapolerede temperaturer.
Resultaterne og modellerne er publiceret som et open-access papir i det peer-reviewede internationale tidsskrift ChemPhysChem . Avisen har allerede rejst mange kommentarer, og forbedringerne bliver nu indarbejdet i en nyere version af HSPiP-softwaren.
Mens de fleste af de faktiske industrielle formuleringsdata er fortrolige, det fælles team har offentliggjort open-access den fulde beskrivelse af teorien og modellerne. De inkluderede også de fulde og kommenterede Matlab-rutiner i den understøttende information, gør det muligt for alle at bruge disse nye værktøjer til at designe nye opløsningsmiddelblandinger og formuleringer.
Prof. Rothenberg ser udgivelse af værktøjer som nøglen til succesfulde offentlig-private partnerskaber mellem industri og akademisk verden. "Industrielle partnere skal holde deres data fortrolige, men de fleste af dem indser, at open-access publicering af metoderne og værktøjerne skaber goodwill og muliggør videreudvikling af både samarbejdspartnere og konkurrenter. Ved at dele metoder og værktøjer, virksomheder kan drage fordel af hinandens viden uden at ofre data.'
 Varme artikler
Varme artikler
-
 Modificeret enzym bruges til at give bedre anti-Markovnikov-selektivitet i alkenoxidationerAnti-Markovnikov oxidation af alkener. Kredit:(c) Videnskab (2017). DOI:10.1126/science.aao1482 (Phys.org) – Et team af forskere ved California Institute of Technology har brugt et modificeret e
Modificeret enzym bruges til at give bedre anti-Markovnikov-selektivitet i alkenoxidationerAnti-Markovnikov oxidation af alkener. Kredit:(c) Videnskab (2017). DOI:10.1126/science.aao1482 (Phys.org) – Et team af forskere ved California Institute of Technology har brugt et modificeret e -
 Forskere bruger grønt guld til hurtigt at opdage og identificere skadelige bakterierProfessor Abdennour Abbas og hans forskerhold har udført grundforskning i samspillet mellem guldnanopartikler og celleoverflader for at skabe nye sensorer. Forskelligt formede guldnanopartikler som de
Forskere bruger grønt guld til hurtigt at opdage og identificere skadelige bakterierProfessor Abdennour Abbas og hans forskerhold har udført grundforskning i samspillet mellem guldnanopartikler og celleoverflader for at skabe nye sensorer. Forskelligt formede guldnanopartikler som de -
 Med nanopore sansning, fysikforskere opdager subtile ændringer i enkelte partiklerResistiv puls nanopore sensing er baseret på ideen om, at små ændringer i strømmen, der bevæger sig gennem en nanopore (grøn, venstre) kan bruges til at lære om molekyler indeholdt. Forskerne var i st
Med nanopore sansning, fysikforskere opdager subtile ændringer i enkelte partiklerResistiv puls nanopore sensing er baseret på ideen om, at små ændringer i strømmen, der bevæger sig gennem en nanopore (grøn, venstre) kan bruges til at lære om molekyler indeholdt. Forskerne var i st -
 Ved hjælp af almindelig tape, forskere laver chip, der kan fremskynde udviklingen af lægemidlerEt forenklet skema af det tape-baserede barriere-on-a-chip system. Kredit:KTH Kgl. Teknologisk Institut Med almindelig dobbeltklæbende tape, forskere i Sverige samlede en chip-baseret model af en
Ved hjælp af almindelig tape, forskere laver chip, der kan fremskynde udviklingen af lægemidlerEt forenklet skema af det tape-baserede barriere-on-a-chip system. Kredit:KTH Kgl. Teknologisk Institut Med almindelig dobbeltklæbende tape, forskere i Sverige samlede en chip-baseret model af en
- Et skridt mod personlig, automatiserede smarte hjem
- Hvordan påvirker Latitude påvirkning af klima?
- En smart elektrisk scooter til forbedring af bymobilitet
- Et genomisk bud på geobiologi
- Mikroplast kan påvirke, hvordan arktisk havis dannes og smelter
- Outback-teleskop indfanger Mælkevejens centrum, opdager rester af døde stjerner


