Hvad sker der, når fluor reagerer med vand?
reaktionen:
* fluor (F₂) reagerer med vand (H₂O) for at producere iltgas (O₂), hydrofluorinsyre (HF) og hydrogenperoxid (H₂O₂).
Den afbalancerede kemiske ligning er:
2 F₂ + 2 H₂O → O₂ + 4 HF + H₂O₂
hvad gør det så reaktivt:
* fluor er det mest elektronegative element , hvilket betyder, at det har en stærk tendens til at tiltrække elektroner.
* F-F-obligationen er svag , hvilket gør det let for fluormolekyler at bryde fra hinanden.
* vand har polære obligationer , hvilket gør det modtageligt for angreb fra Fluoras stærke elektrontrækkende kraft.
Resultatet:
* Eksplosiv reaktion: Reaktionen frigiver en betydelig mængde varme, hvilket potentielt fører til en eksplosion.
* Dannelse af ætsende syrer: Hydrofluorsyre (HF) er ekstremt ætsende og kan skade hud, øjne og endda knogler.
* Produktion af giftige biprodukter: Hydrogenperoxid (H₂O₂) er også en stærk oxidation og kan være skadelig.
sikkerhed:
* fluordas er meget giftig og ætsende.
* Håndter aldrig fluor eller dens reaktioner uden korrekt sikkerhedsudstyr og ekspertovervågning.
Hvorfor er det vigtigt at vide dette?
Det er vigtigt at forstå fluorens reaktivitet med vand:
* Kemisk sikkerhed: At kende farerne giver mulighed for korrekt håndtering og opbevaring af fluor.
* Industrielle processer: Fluor bruges til produktion af forskellige kemikalier, og dens reaktioner skal kontrolleres omhyggeligt.
* miljøbeskyttelse: At undgå utilsigtede fluorfrigivelser er afgørende for sikkerheden ved økosystemer og menneskers sundhed.
Sidste artikelEr alle atomer af det samme element kemisk ens?
Næste artikelHvad er det standard elektrodepotentiale for svovl?
 Varme artikler
Varme artikler
-
 Video:Sådan gløder dyrKredit:The American Chemical Society Ildfluer, frøer, vandmand, svampe og endda papegøjer har evnen til at udsende lys fra deres kroppe. Disse væsner bruger enten bioluminescens eller fluorescens
Video:Sådan gløder dyrKredit:The American Chemical Society Ildfluer, frøer, vandmand, svampe og endda papegøjer har evnen til at udsende lys fra deres kroppe. Disse væsner bruger enten bioluminescens eller fluorescens -
 Udarbejdelse af protokoller til fremstilling af deutererede biomolekylerKredit:SINE2020 Neutronteknikker er gode til at studere lette atomer som brint - fantastisk til biologiske molekyler, der indeholder et stort antal af dem. Neutroner er særligt følsomme over for i
Udarbejdelse af protokoller til fremstilling af deutererede biomolekylerKredit:SINE2020 Neutronteknikker er gode til at studere lette atomer som brint - fantastisk til biologiske molekyler, der indeholder et stort antal af dem. Neutroner er særligt følsomme over for i -
 Brændstof fra diamanter?Kredit:Anke Krueger - Patty Varasano Europæiske forskere undersøger nye metoder til at reducere koncentrationen af kuldioxid i atmosfæren, med henblik på at udnytte dem. Hvis det lykkes, deres e
Brændstof fra diamanter?Kredit:Anke Krueger - Patty Varasano Europæiske forskere undersøger nye metoder til at reducere koncentrationen af kuldioxid i atmosfæren, med henblik på at udnytte dem. Hvis det lykkes, deres e -
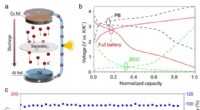 Konstruktion af kulstofbaserede celle-lignende kugler til robust kaliumanode(a) Skematisk illustration af K-ion-fuldbatteriet baseret på det forberedte BCC og Preussisk blå (PB). (b) Opladningsafladningsprofiler for halvbatteriet og fuldt batteri. (c) Cykelstabilitet ved 500
Konstruktion af kulstofbaserede celle-lignende kugler til robust kaliumanode(a) Skematisk illustration af K-ion-fuldbatteriet baseret på det forberedte BCC og Preussisk blå (PB). (b) Opladningsafladningsprofiler for halvbatteriet og fuldt batteri. (c) Cykelstabilitet ved 500


