Hvordan er syrer og baser forskellige, hvordan adskiller deres pH -værdier sig?
syrer og baser:en fortælling om to ekstremer
Syrer og baser er to grundlæggende typer kemiske stoffer med kontrasterende egenskaber. Sådan adskiller de sig:
1. Kemisk definition:
* syrer: Stoffer, der donerer brintioner (H+) i en opløsning.
* baser: Stoffer, der accepterer hydrogenioner (H+) i en opløsning, eller donerer hydroxidioner (OH-) i en opløsning.
2. Smag:
* syrer: Typisk surt. Tænk på citronsaft eller eddike.
* baser: Typisk bitter og føles glat at røre ved. Tænk på sæbe eller bagepulver.
3. PH -skala:
* syrer: Har en pH -værdi mindre end 7. Jo lavere pH, jo stærkere er syren.
* baser (eller alkalier): Har en pH -værdi større end 7. Jo højere pH, jo stærkere er basen.
* neutrale stoffer: Har en pH på 7, som rent vand.
4. Kemiske reaktioner:
* syrer: Reager med baser for at danne salte og vand.
* baser: Reager med syrer for at danne salte og vand.
5. Eksempler:
* syrer: Hydrochlorsyre (HCI), svovlsyre (H2SO4), citronsyre (findes i citrusfrugter)
* baser: Natriumhydroxid (NaOH), calciumhydroxid (Ca (OH) 2), ammoniak (NH3)
Kortfattet:
* Syrer er hydrogenion -donorer og har en pH -værdi mindre end 7.
* Baser er hydrogenionacceptorer eller hydroxidiondonorer og har en pH -værdi større end 7.
PH -skalaen er en logaritmisk skala, hvilket betyder, at hver enhedsændring i pH repræsenterer en ti gange ændring i surhed eller grundlæggende. For eksempel er en opløsning med en pH -værdi på 3 gange mere sur end en opløsning med en pH på 4.
At forstå forskellene mellem syrer og baser er afgørende inden for forskellige områder, herunder kemi, biologi og hverdag. At kende et stofs pH er for eksempel vigtigt for at kontrollere dets egenskaber og anvendelser.
Sidste artikelHvad hedder Covalent Compound Sci4?
Næste artikelEr en brutto -formel molekylærformel?
 Varme artikler
Varme artikler
-
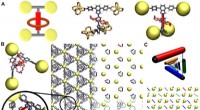 Fysikere afkoder den dynamiske interaktion mellem molekylære maskiner i metal-organiske rammerMolekylær struktur af den rotaxanfunktionaliserede MOF.(A ) Repræsentation af én organisk linker, der forbinder fire uorganiske Zn4 O hjørner. Det venstre billede skitserer byggestenens struktur, det
Fysikere afkoder den dynamiske interaktion mellem molekylære maskiner i metal-organiske rammerMolekylær struktur af den rotaxanfunktionaliserede MOF.(A ) Repræsentation af én organisk linker, der forbinder fire uorganiske Zn4 O hjørner. Det venstre billede skitserer byggestenens struktur, det -
 Kemiske ingeniører replikerer foder, kamp og flugt-reaktioner i katalytiske kemiske reaktionerOverfladearealet af aktive steder på den røde krabbe er dobbelt så stort som på den grønne grab; derfor, den røde krabbe trækker partikler væk fra grønne konkurrenter ved at generere stærkere indadgåe
Kemiske ingeniører replikerer foder, kamp og flugt-reaktioner i katalytiske kemiske reaktionerOverfladearealet af aktive steder på den røde krabbe er dobbelt så stort som på den grønne grab; derfor, den røde krabbe trækker partikler væk fra grønne konkurrenter ved at generere stærkere indadgåe -
 Forskere afslører ny dobbelt-roaming-mekanisme i kemisk reaktion3D polært plot for produktets translationelle energi og vinkelfordelinger. Kredit:FU Yanlin Roaming, en ny mekanisme i reaktionsdynamik, beskriver en usædvanlig vej, der er ret forskellig fra den
Forskere afslører ny dobbelt-roaming-mekanisme i kemisk reaktion3D polært plot for produktets translationelle energi og vinkelfordelinger. Kredit:FU Yanlin Roaming, en ny mekanisme i reaktionsdynamik, beskriver en usædvanlig vej, der er ret forskellig fra den -
 De lysaktive biomolekylers mange strukturerI sin doktorafhandling, Tufa Assafa låser op for lysfølsomme biomolekylers hemmeligheder. Kredit:RUB, Kramer Hvordan den lysfølsomme del af biomolekylet phytochrom ændrer sig fra en lys-tilpasset
De lysaktive biomolekylers mange strukturerI sin doktorafhandling, Tufa Assafa låser op for lysfølsomme biomolekylers hemmeligheder. Kredit:RUB, Kramer Hvordan den lysfølsomme del af biomolekylet phytochrom ændrer sig fra en lys-tilpasset


