Hvilket element er mindst sandsynligt, at en ionisk binding med natrium?
* Forståelse af ioniske bindinger: Ioniske bindinger dannes, når et atom (normalt et metal) mister elektroner for at blive en positivt ladet ion (kation), og et andet atom (normalt en ikke -metal) får disse elektroner til at blive en negativt ladet ion (anion). De modsatte afgifter tiltrækker derefter og danner bindingen.
* Natriums opførsel: Natrium (NA) er et meget reaktivt metal. Det mister let sin enkelt valenselektron for at blive en +1 -kation (Na +).
* på udkig efter den mindst sandsynlige partner: For at danne en ionisk binding har natrium brug for et element, der let får et elektron. Dette betyder, at vi har brug for et element med en høj elektronegativitet (tendens til at tiltrække elektroner). De elementer, der er mindst sandsynlige for at danne ioniske bindinger med natrium, er dem med:
* Lav elektronegativitet: Disse elementer er mere tilbøjelige til at miste elektroner selv, hvilket gør det mindre gunstigt for dem at få et elektron fra natrium.
* Lignende elektronegativitet som natrium: Elementer med lignende elektronegativitet vil være mere tilbøjelige til at dele elektroner og danne en kovalent binding i stedet for det ene atom, der helt tager et elektron fra det andet.
Eksempler på elementer, der er mindre tilbøjelige til at danne ioniske bindinger med natrium:
* Andre metaller: Metaller har generelt lav elektronegativitet og vil sandsynligvis miste elektroner og ikke få dem. For eksempel ville kalium (K) eller calcium (CA) være mindre tilbøjelige til at danne ioniske bindinger med natrium.
* ædle gasser: Noble gasser har en fuld ydre skal af elektroner, hvilket gør dem meget stabile og ureaktive. Det er usandsynligt, at de får eller mister elektroner til dannelse af ioniske bindinger.
Derfor ville elementet, der er mindst sandsynligt, at danne en ionisk binding med natrium, være en ædel gas.
 Varme artikler
Varme artikler
-
 Forbrugere, quats og COVID-19:Er desinfektionsprodukter sikre?Kredit:CC0 Public Domain I lyset af en vedvarende global pandemi, desinfektionsmidler er vigtigere end nogensinde. Disse produkter er nogle gange afhængige af kvaternære ammoniumforbindelser, elle
Forbrugere, quats og COVID-19:Er desinfektionsprodukter sikre?Kredit:CC0 Public Domain I lyset af en vedvarende global pandemi, desinfektionsmidler er vigtigere end nogensinde. Disse produkter er nogle gange afhængige af kvaternære ammoniumforbindelser, elle -
 Ny tilgang til katalyse reducerer kuldioxid til metanDenne særlige overflade af kobber og sølv er vigtig for at opnå rækken af kemiske reaktioner i systemet, teamet designede. Kredit:University of Delaware Et stigende antal forskere leder hurtigt
Ny tilgang til katalyse reducerer kuldioxid til metanDenne særlige overflade af kobber og sølv er vigtig for at opnå rækken af kemiske reaktioner i systemet, teamet designede. Kredit:University of Delaware Et stigende antal forskere leder hurtigt -
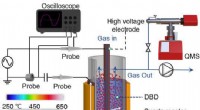 Ikke-termisk plasma-promoveret CO2-hydrogenering i nærværelse af legeringskatalysatorerFigur 1. Kuldioxidgenanvendelse - innovativt plasmakatalysekoncept. Dielektrisk barriereudladningsreaktor med fluidiseret leje blev brugt til CO2-hydrogenering over Pd2 Ga/SiO2 . Kredit:Journal of the
Ikke-termisk plasma-promoveret CO2-hydrogenering i nærværelse af legeringskatalysatorerFigur 1. Kuldioxidgenanvendelse - innovativt plasmakatalysekoncept. Dielektrisk barriereudladningsreaktor med fluidiseret leje blev brugt til CO2-hydrogenering over Pd2 Ga/SiO2 . Kredit:Journal of the -
 Forskere udvikler luftkvalitetssensor, der kan redde liv for babyer og astmapatienterKredit:CC0 Public Domain Forskere ved University of Sussex har samarbejdet med et Oxford -firma, M-SOLV, og et team af forskere fra hele Europa for at udvikle et meget følsomt og præcist nitrogend
Forskere udvikler luftkvalitetssensor, der kan redde liv for babyer og astmapatienterKredit:CC0 Public Domain Forskere ved University of Sussex har samarbejdet med et Oxford -firma, M-SOLV, og et team af forskere fra hele Europa for at udvikle et meget følsomt og præcist nitrogend
- Forskningsgruppen opdager oprindelsen af blæksprutter øjeblikkelig modulering af kropens farve
- Hvilken er mest hastighed i verden?
- Hvilken form for energi producerer geotermisk?
- Hvor farlig er ekstrem varme for mennesker?
- Har vi mødtes? Forskning finder 'manglende social viden'
- Hvad tid passerer Jorden gennem områder med affald i solsystemet?


