Tegn elektronprikdiagrammet, der viser kalium, der danner en kemisk binding med brom?
1. Bestem valenselektronerne
* kalium (k): Gruppe 1, så det har 1 valenselektron.
* brom (Br): Gruppe 17, så det har 7 valenselektroner.
2. Repræsentere atomerne
* Brug elementsymbolet (K og BR) til at repræsentere atomerne.
* Placer prikker omkring symbolet for at repræsentere valenselektronerne. Husk at følge Hunds regel (hver orbital får en elektron inden parring).
3. Vis overførslen af elektroner
* Kalium (K) mister sin ene valenselektron for at blive en positivt ladet ion (K+).
* Brom (BR) får en elektron til at blive en negativt ladet ion (BR-).
4. Tegn den endelige struktur
* Vis ionerne side om side med elektronoverførslen angivet med en pil.
Her er det sidste diagram:
`` `
.
K. → BR:
.
. . .
`` `
Forklaring:
* Pilen viser elektronet, der bevæger sig fra kaliumatomet til bromatomet.
* De resulterende ioner (K+ og Br-) har nu en komplet ydre skal, hvilket gør dem mere stabile.
* Den elektrostatiske tiltrækning mellem de modsatte ladede ioner danner den ioniske binding.
Sidste artikelHvad er gashydrat?
Næste artikelHvor mange atomer er der i 3,91 mol natrium?
 Varme artikler
Varme artikler
-
 Forskere peger på, hvordan sorberende materialer fanger og frigiver kulstofKredit:Unsplash/CC0 Public Domain En nøglekomponent i DAC-systemer (ambient direct air capture), der fjerner kuldioxid fra luften, er det sorberende materiale, der bruges til først at opfange kuls
Forskere peger på, hvordan sorberende materialer fanger og frigiver kulstofKredit:Unsplash/CC0 Public Domain En nøglekomponent i DAC-systemer (ambient direct air capture), der fjerner kuldioxid fra luften, er det sorberende materiale, der bruges til først at opfange kuls -
 En ny guldstandardforbindelse til generering af elektricitet fra varmeKredit:Pixabay/CC0 Public Domain Termoelektriske kraftgeneratorer, der laver elektrisk strøm fra spildvarme, ville være et nyttigt værktøj til at reducere drivhusgasemissioner, hvis det ikke var f
En ny guldstandardforbindelse til generering af elektricitet fra varmeKredit:Pixabay/CC0 Public Domain Termoelektriske kraftgeneratorer, der laver elektrisk strøm fra spildvarme, ville være et nyttigt værktøj til at reducere drivhusgasemissioner, hvis det ikke var f -
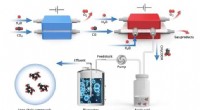 Hybrid elektro-biosystem opcykler kuldioxid til energirige langkædede forbindelserSkematisk diagram af in vitro kuldioxidsyntese af højenergi-langkædede fødevaremolekyler. Kredit:SIAT Kunstig upcycling af kuldioxid (CO2 ) til værditilvækstprodukter på en bæredygtig måde repræsen
Hybrid elektro-biosystem opcykler kuldioxid til energirige langkædede forbindelserSkematisk diagram af in vitro kuldioxidsyntese af højenergi-langkædede fødevaremolekyler. Kredit:SIAT Kunstig upcycling af kuldioxid (CO2 ) til værditilvækstprodukter på en bæredygtig måde repræsen -
 En ny metode til samtidig behandling af forskellige typer affaldKredit:CC0 Public Domain Et internationalt forskerhold er kommet med en innovativ metode til metalgenvinding fra industriaffald. Den nye metode tillader samtidig genvinding af flere metaller fra s
En ny metode til samtidig behandling af forskellige typer affaldKredit:CC0 Public Domain Et internationalt forskerhold er kommet med en innovativ metode til metalgenvinding fra industriaffald. Den nye metode tillader samtidig genvinding af flere metaller fra s
- Hvorfor konverterer en elektrisk ventilator elektrisk energi til bevægelse?
- Hvad er måne til jorden?
- Hvilken sekvens er korrekt for mitose?
- Tårnhøje obelisker er overalt. Her er hvorfor de er så ærefrygtindgydende
- Hvad er atomnummeret og massen af ilt?
- Salt tager et hurtigt skridt, før det falder ud af vandet


