Hvad sker der, når ammoniumchlorid tilsættes til vand?
1. opløsning: De ioniske bindinger i ammoniumchloridkrystallgitterpausen, og de individuelle ioner (NH₄⁺ og CL⁻) frigøres i vandet.
2. Hydrering: De frigivne ioner bliver omgivet af vandmolekyler. De positivt ladede ammoniumioner (NH₄⁺) tiltrækker de negativt ladede iltender af vandmolekyler, mens de negativt ladede chloridioner (CL⁻) tiltrækker de positivt ladede hydrogenender af vandmolekyler. Denne proces kaldes hydrering.
3. Dannelse af en vandig opløsning: De hydratiserede ioner er nu frie til at bevæge sig rundt i opløsningen og danne en homogen blanding af ammonium- og chloridioner i vand.
samlet reaktion:
NH₄CL (S) + H₂O (L) → NH₄⁺ (AQ) + CL⁻ (AQ)
Vigtige punkter at bemærke:
* Løsningen bliver let sur På grund af hydrolyse af ammoniumioner (NH₄⁺). Ammoniumioner kan donere en proton (H⁺) til vandmolekyler, der danner hydroniumioner (H₃O⁺), der gør opløsningen sur.
* Opløsningen af ammoniumchlorid er en endotermisk proces , hvilket betyder, at det absorberer varme fra omgivelserne. Dette kan observeres som et lille fald i temperaturen på vandet.
* Opløsningens pH afhænger af koncentrationen af ammoniumchlorid. Højere koncentrationer vil resultere i en lavere pH (mere sur).
Anvendelser af ammoniumchlorid:
Ammoniumchlorid har forskellige anvendelser, herunder:
* Gødning: Giver nitrogen til plantevækst
* Fødevaretilsætningsstof: Brugt som gærnærings- og surhedsregulator
* Medicin: Brugt i hostesirupper og slimsigter
* elektroplettering: Bruges som elektrolyt
* Tekstilindustri: Bruges som mordant og i farvningsprocesser
Sidste artikelHvad er afbalanceringsligningen af HCL plus caco3-cacl2 H20 CO2?
Næste artikelHvad er produktet af jern og kobber II sulfat?
 Varme artikler
Varme artikler
-
 Indbygget gassensorenhed lover enkel, nøjagtig påvisning af flygtige organiske forbindelserI gennemgang af videnskabelige instrumenter, forskere ved Gdańsk University of Technology beskriver en måleanordning designet til at analysere luftprøver indeholdende forskellige flygtige organiske fo
Indbygget gassensorenhed lover enkel, nøjagtig påvisning af flygtige organiske forbindelserI gennemgang af videnskabelige instrumenter, forskere ved Gdańsk University of Technology beskriver en måleanordning designet til at analysere luftprøver indeholdende forskellige flygtige organiske fo -
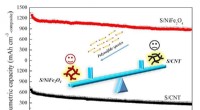 Nikkelferrit fremmer lithium-svovlbatteriets kapacitet og cyklusstabilitetSammenlignet med S/CNTer, S/NiFe2O4 har højere volumetrisk kapacitet og cykelstabilitet. Kredit:©Science China Press Lithium-svovl (Li-S) batteri kan blive praktisk, hvis 20 procent af de teoretis
Nikkelferrit fremmer lithium-svovlbatteriets kapacitet og cyklusstabilitetSammenlignet med S/CNTer, S/NiFe2O4 har højere volumetrisk kapacitet og cykelstabilitet. Kredit:©Science China Press Lithium-svovl (Li-S) batteri kan blive praktisk, hvis 20 procent af de teoretis -
 Ny produktionsteknik til højtydende polymer kunne give bedre rustningEn ny katalysator fremstillet af legerede nanopartikler af guld og palladium kan producere PBO-polymer, som bruges i kropsrustninger og andre højtydende stoffer. Den nye katalysator producerer PBO, de
Ny produktionsteknik til højtydende polymer kunne give bedre rustningEn ny katalysator fremstillet af legerede nanopartikler af guld og palladium kan producere PBO-polymer, som bruges i kropsrustninger og andre højtydende stoffer. Den nye katalysator producerer PBO, de -
 Flertrins deformationsproces i højentropi-legeringer ved ultralave temperaturer afsløretDeformationsvej for CrMnFeCoNi HEA-prøve ved 15 K. Lodrette stiplede linjer er tegnet for at udpege ændringerne i deformationsadfærden:(1) Start af dislokationsglidning; (2) start af stablingsfejl; (3
Flertrins deformationsproces i højentropi-legeringer ved ultralave temperaturer afsløretDeformationsvej for CrMnFeCoNi HEA-prøve ved 15 K. Lodrette stiplede linjer er tegnet for at udpege ændringerne i deformationsadfærden:(1) Start af dislokationsglidning; (2) start af stablingsfejl; (3
- Små partikler, store resultater:Maksimering af energigevinster fra små nanopartikler
- Svag selvkontrol, sociale medier og målrettet annoncering øger impulskøb, siger undersøgelse
- Hvilken atommasse har ekasilicon?
- Hvad er homofonen for gener?
- Det sammenkoblede Oceanic Ridge -system er kendt for hvilken funktion?
- 3 Million Candle Power Spot Light Vs. 600 Lumens Spotlight


