Hvordan er oxidation i kemi, hvilken stat nano3?
Oxidation i kemi
* Definition: Oxidation er en kemisk proces, hvor et stof mister elektroner. Dette involverer ofte forstærkning af iltatomer eller tab af brintatomer.
* Nøglepunkter:
* Tab af elektroner: Kernekonceptet er tabet af negativt ladede elektroner.
* Forøgelse i oxidationstilstand: Elementet, der gennemgår oxidation, vil have sit oxidationsnummer stigning.
* ofte med ilt: Oxygen er et meget elektronegativt element, hvilket betyder, at det tiltrækker elektroner kraftigt. Det fungerer ofte som et oxidationsmiddel, hvilket får andre stoffer til at miste elektroner.
tilstand Nano3
* nano3:natriumnitrat Dette er en ionisk forbindelse, hvilket betyder, at den dannes af den elektrostatiske tiltrækning mellem positivt og negativt ladede ioner.
* Oxidation siger:
* na (natrium):+1 Natrium er i gruppe 1 i den periodiske tabel, hvilket betyder, at den typisk mister en elektron til dannelse af en +1 -kation.
* n (nitrogen):+5 Nitrogen er i en mere kompleks situation. I nitrat (NO3-) er den samlede ladning -1, og ilt har en -2 oxidationstilstand (typisk). For at afbalancere dette skal nitrogen have en +5 oxidationstilstand.
* o (ilt):-2 Oxygen er i gruppe 16 og danner typisk en -2 -anion.
Oxidation i Nano3
* Ingen oxidation eller reduktion: Oxidationstilstandene for elementerne i Nano3 er allerede fast. Forbindelsen er i en stabil tilstand, uden yderligere overførsel af elektroner, der sker inden for selve forbindelsen.
Kortfattet
Mens oxidation er et grundlæggende koncept inden for kemi, sker det ikke inden for den stabile struktur af NANO3. Selve forbindelsen findes i en afbalanceret tilstand med definerede oxidationsnumre.
Sidste artikelEr jernholdigt chlorid og ferrisk det samme?
Næste artikelHvad er fordelene ved chlorofluorcarbons?
 Varme artikler
Varme artikler
-
 Forskning går til nye dybder i hudpeptidundersøgelserDavid Scurr, Seniorforsker, Farmaceutisk Skole. Kredit:University of Nottingham Forskere har for første gang afsløret, at et peptid i et førende skønhedsprodukt kan trænge ind i hudens hårde strat
Forskning går til nye dybder i hudpeptidundersøgelserDavid Scurr, Seniorforsker, Farmaceutisk Skole. Kredit:University of Nottingham Forskere har for første gang afsløret, at et peptid i et førende skønhedsprodukt kan trænge ind i hudens hårde strat -
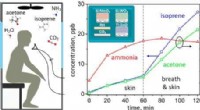 Bærbar enhed til at snuse ud fangede menneskerKredit:American Chemical Society Det første trin efter bygninger kollapsede fra et jordskælv, bombning eller anden katastrofe er at redde mennesker, der kunne blive fanget i murbrokkerne. Men at f
Bærbar enhed til at snuse ud fangede menneskerKredit:American Chemical Society Det første trin efter bygninger kollapsede fra et jordskælv, bombning eller anden katastrofe er at redde mennesker, der kunne blive fanget i murbrokkerne. Men at f -
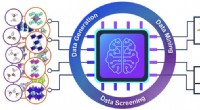 Datavidenskab hjælper ingeniører med at opdage nye materialer til solceller og LED'erSkematisk illustration af arbejdsgangen for high-throughput design af organisk-uorganisk hybrid halogenid-halvledere til solceller og lysdioder. Kredit:Yang lab/Energy &Environmental Science Ingen
Datavidenskab hjælper ingeniører med at opdage nye materialer til solceller og LED'erSkematisk illustration af arbejdsgangen for high-throughput design af organisk-uorganisk hybrid halogenid-halvledere til solceller og lysdioder. Kredit:Yang lab/Energy &Environmental Science Ingen -
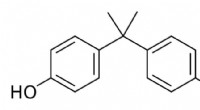 Hvad er BPA, og hvorfor er det i så mange plastikprodukter?Bisphenol A er lavet af to kulstofringe med små alkoholgrupper knyttet og bruges til at fremstille stærk, klar plast. Kredit:Darkness3560/Wikimedia Commons Bisphenol A, eller BPA, er et kemikalie,
Hvad er BPA, og hvorfor er det i så mange plastikprodukter?Bisphenol A er lavet af to kulstofringe med små alkoholgrupper knyttet og bruges til at fremstille stærk, klar plast. Kredit:Darkness3560/Wikimedia Commons Bisphenol A, eller BPA, er et kemikalie,
- Hvad er en begrænsning af bromthymolblåt?
- Forskere opretter sub-10-nanometer grafen-nanoribbon-mønstre
- Hvordan Sun leverer energi?
- Sådan konverteres HP til Amps & Volts
- Hvordan bestemmer accelerationen af faldende kroppe eksperimentelt?
- Hvor meget arbejde udføres på et objekt, der rejser 3 meter under en konstant kraft på 2 Newtons?…


