Hvorfor reagerer natriumhydroxid med nitrogendioxid for at give nitrat og nitrit på samme tid?
Her er en oversigt over de vigtigste faktorer:
1. Kvælstofdioxides reaktivitet:
* Ingen Denne dualitet er afgørende i dannelsen af både nitrat og nitrit.
2. Disproportioneringsreaktion:
* Når ingen reagerer med NaOH, gennemgår det en uforholdsmæssig reaktion. I denne type reaktion er den samme art både oxideret og reduceret.
* I dette tilfælde reduceres nogle NO₂ -molekyler til nitritioner (NO₂⁻), mens andre oxideres til nitrationer (NO₃⁻).
3. Redox -reaktioner:
* reduktion af ingen₂ til ingen₂⁻:
* NO₂ + E⁻ → NO₂⁻
* oxidation af ingen₂ til ingen₃⁻:
* NO₂ + H₂O → NO₃⁻ + 2H⁺ + 2E⁻
4. Samlet reaktion:
Den samlede reaktion kan sammenfattes som:
2NO₂ + 2NAOH → NANO₃ + NANO₂ + H₂O
5. Faktorer, der påvirker produktforholdet:
De relative mængder nitrat og nitrit, der er dannet, afhænger af faktorer som:
* koncentration af reaktanter: Højere NO₂ -koncentrationer har en tendens til at favorisere nitratdannelse.
* Temperatur og pH: Reaktionen er følsom over for temperatur og pH.
* tilstedeværelse af andre arter: Katalysatorer eller andre reaktanter kan påvirke resultatet.
Konklusion:
Dannelsen af både nitrat og nitrit i reaktionen af NaOH med NO₂ er et resultat af molekylets evne til at fungere som både en oxidant og et reduktionsmiddel, hvilket fører til en uforholdsmæssig reaktion. Det komplekse samspil mellem redoxreaktioner, koncentration og andre faktorer bestemmer det specifikke forhold mellem de dannede produkter.
 Varme artikler
Varme artikler
-
 Forskerteam omvendt måde kaliumkanaler fungerer fra bakterier til menneskerGennem deres forskning, Cuello, sammen med D. Marien Cortes, bestemt, hvordan man får hidtil uset viden og kontrol over kaliumkanaler. Kredit:TTUHSC For første gang nogensinde, forskere ved Texas
Forskerteam omvendt måde kaliumkanaler fungerer fra bakterier til menneskerGennem deres forskning, Cuello, sammen med D. Marien Cortes, bestemt, hvordan man får hidtil uset viden og kontrol over kaliumkanaler. Kredit:TTUHSC For første gang nogensinde, forskere ved Texas -
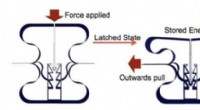 Forskere designer materiale, der kan lagre energi som et ørnegrebDen skraldende byggeklods, der kunne indlejres i de nye materialer. Efter lodret kompression, det holder materialer kollapset, og kan frigive deres energi på side-vejs pull. Kredit:Stoyan Smoukov
Forskere designer materiale, der kan lagre energi som et ørnegrebDen skraldende byggeklods, der kunne indlejres i de nye materialer. Efter lodret kompression, det holder materialer kollapset, og kan frigive deres energi på side-vejs pull. Kredit:Stoyan Smoukov -
 Forskere udvikler diagnostisk værktøj til påvisning af cryptosporidiumIngeniørdoktorand George Luka siger, at der er et presserende behov for at udvikle en hurtig, fleksibel, nøjagtigt og realtidsdetektionsværktøj til at klare udfordringen med at beskytte vandforbrugere
Forskere udvikler diagnostisk værktøj til påvisning af cryptosporidiumIngeniørdoktorand George Luka siger, at der er et presserende behov for at udvikle en hurtig, fleksibel, nøjagtigt og realtidsdetektionsværktøj til at klare udfordringen med at beskytte vandforbrugere -
 Sætter scenen for brændstofeffektiv gødningKredit:ACS Ammoniak, den primære ingrediens i nitrogenbaserede gødninger, har hjulpet med at brødføde verden siden 1. Verdenskrig. Men at lave ammoniak i industriel skala kræver meget energi, og d
Sætter scenen for brændstofeffektiv gødningKredit:ACS Ammoniak, den primære ingrediens i nitrogenbaserede gødninger, har hjulpet med at brødføde verden siden 1. Verdenskrig. Men at lave ammoniak i industriel skala kræver meget energi, og d
- Hvor mange stjerner har hver planet?
- Bliver klipper den samme form for evigt?
- Hvad er breddegrad i det nordligste punkt Indien?
- Forskere udvikler nye kort for at hjælpe med at beskytte vigtige arktiske økosystemer
- Forklar, hvorfor videnskabsmænd tror, at Jorden udviklede sig i en række lag?
- Kunne en partikelaccelerator ved hjælp af laserdrevet implosion blive virkelighed?


