Hvad sker der med molekyler, når vand koges?
* Øget kinetisk energi: Varmeenergi tilsættes til vandet, hvilket får vandmolekylerne til at vibrere og bevæge sig hurtigere.
* svækkelse af brintbindinger: Den øgede kinetiske energi overvinder de attraktive kræfter (hydrogenbindinger), der holder vandmolekyler sammen i en flydende tilstand.
* faseændring: Når molekylerne får nok energi, slipper de fri fra væskestrukturen og overgår til en gasformig tilstand, som er damp.
* øget afstand mellem molekyler: I den gasformige tilstand er vandmolekylerne langt længere fra hinanden end i flydende tilstand.
Her er en mere detaljeret forklaring:
1. flydende tilstand: I flydende vand er molekyler tæt sammen og bevæger sig konstant rundt, konstant fremstiller og bryder brintbindinger. Disse bindinger er relativt stærke og holder molekylerne sammen.
2. Opvarmning: Når der påføres varme, absorberer vandmolekyler energi. Denne energi øger deres kinetiske energi, hvilket får dem til at vibrere hurtigere og bevæge sig hurtigere rundt.
3. Breaking Bonds: Når molekylerne bevæger sig hurtigere, begynder brintbindingerne mellem dem at svækkes.
4. fordampning: Når nok energi absorberes, har molekylerne nok kinetisk energi til at overvinde de attraktive kræfter fuldstændigt. De bryder sig fri fra flydende tilstand og går ind i den gasformige tilstand som damp.
5. Gasformet tilstand: I den gasformige tilstand er vandmolekylerne langt fra hinanden og bevæger sig frit. De kolliderer med hinanden og containervæggene, men kollisionerne er mindre hyppige og mindre kraftfulde end i flydende tilstand.
Det er vigtigt at bemærke: Kogepunktet for vand er 100 ° C (212 ° F) ved standard atmosfæretryk. Ved denne temperatur har vandmolekylerne nok energi til at overvinde de attraktive kræfter og flygte ind i gasfasen. Temperaturen, hvorpå vand koger, kan dog variere afhængigt af trykket.
Sidste artikelIs -kilning er en form for kemisk forvitring.?
Næste artikelHvilke mineraler er der i en printer?
 Varme artikler
Varme artikler
-
 Forskere udvikler en bedre metode til at fjerne giftige farvestoffer fra spildevandForskere spinder funktionaliserede nanowebs. Kredit:Texas Tech University Ved at bruge specielt fremstillede nanofiberbaner kan sollys nedbryde farvestofferne sikkert, billigt og nemt. Fra sundhe
Forskere udvikler en bedre metode til at fjerne giftige farvestoffer fra spildevandForskere spinder funktionaliserede nanowebs. Kredit:Texas Tech University Ved at bruge specielt fremstillede nanofiberbaner kan sollys nedbryde farvestofferne sikkert, billigt og nemt. Fra sundhe -
 Forskere opnår direkte elektrokatalytisk reduktion af kuldioxid, skaber håb om smart kulstofopsaml…CO2 -reduktionsreaktionen finder sted i det katodiske kammer vist til højre. Kredit: Kemisk videnskab Kemikere ved Tokyo Institute of Technology (Tokyo Tech) har foreslået en innovativ måde at op
Forskere opnår direkte elektrokatalytisk reduktion af kuldioxid, skaber håb om smart kulstofopsaml…CO2 -reduktionsreaktionen finder sted i det katodiske kammer vist til højre. Kredit: Kemisk videnskab Kemikere ved Tokyo Institute of Technology (Tokyo Tech) har foreslået en innovativ måde at op -
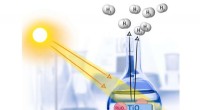 Kemikere tester en ny nanokatalysator til at opnå brintKemikerne overvågede indflydelsen af en titanium-dioxid baseret ruthenium nanokatalysator på emissionen af brint fra en methanol-vand blanding. Kredit:Allen Dressen En kemiker fra RUDN var den
Kemikere tester en ny nanokatalysator til at opnå brintKemikerne overvågede indflydelsen af en titanium-dioxid baseret ruthenium nanokatalysator på emissionen af brint fra en methanol-vand blanding. Kredit:Allen Dressen En kemiker fra RUDN var den -
 Brug af metaller til brændstofKredit:Pixabay/CC0 Public Domain Vidste du, at vi inden for mikrotyngdekraft forbereder et af de mest lovende brændstoffer til fremtiden? Mikrotyngdekraft hjælper med at finde svar og modeller ti
Brug af metaller til brændstofKredit:Pixabay/CC0 Public Domain Vidste du, at vi inden for mikrotyngdekraft forbereder et af de mest lovende brændstoffer til fremtiden? Mikrotyngdekraft hjælper med at finde svar og modeller ti
- Canadas oliesektor står over for betydelige udfordringer for at reducere emissioner
- Nye muligheder for sundheds-, miljøovervågning med vandtæt gassensor
- Hvem laver og reparerer ting lavet af jern?
- Minnesota UFO Sighting fra 1979
- Hvad er den 3 hovedoverflade?
- Forskere diskuterer den nuværende tilstand af homofobi, transfobi og bifobi


