Hvorfor klor fortrænger brom fra kaliumbromidopløsning?
* Elektrokemisk serie: Klor er højere i den elektrokemiske serie end brom. Dette betyder, at klor har en stærkere tendens til at vinde elektroner og danne negative ioner (anioner).
* reaktionsmekanisme: Når klorgas bobles gennem en kaliumbromidopløsning, finder følgende reaktion sted:
`` `
Cl2 (g) + 2kbr (aq) → 2kcl (aq) + br2 (l)
`` `
* forskydning: Chloratomer er mere reaktive og accepterer let elektroner fra bromidioner (BR-), der danner chloridioner (Cl-). Dette overlader bromatomerne til at binde sig sammen og danne flydende brom (BR2), der observeres som en rødbrun farve i opløsningen.
i enklere termer: Chlor er en "stærkere" ikke-metal end brom og "ønsker" elektronerne mere. Så det "stjæler" elektronerne fra brom og tvinger den ud af kaliumbromidopløsningen.
Sidste artikelHvad er antallet af elektroner og neutroner i fluor?
Næste artikelEr aluminiumoxid et element eller forbindelse?
 Varme artikler
Varme artikler
-
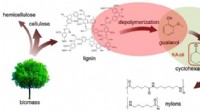 Ny proces gør papirfremstillingsaffald til værdifulde kemikalierKredit:Ames Laboratory En gruppe forskere ved U.S. Department of Energys Ames Laboratory har opdaget en måde at konvertere et fælles biprodukt af papirfremstillingsprocessen til værdifulde kemiske
Ny proces gør papirfremstillingsaffald til værdifulde kemikalierKredit:Ames Laboratory En gruppe forskere ved U.S. Department of Energys Ames Laboratory har opdaget en måde at konvertere et fælles biprodukt af papirfremstillingsprocessen til værdifulde kemiske -
 Ny indsigt i livets oprindelseKredit:American Chemical Society Et berømt forsøg i 1953 viste, at aminosyrer, byggestenene i proteiner, kunne have dannet sig spontant under de atmosfæriske forhold på den tidlige Jord. Imidlerti
Ny indsigt i livets oprindelseKredit:American Chemical Society Et berømt forsøg i 1953 viste, at aminosyrer, byggestenene i proteiner, kunne have dannet sig spontant under de atmosfæriske forhold på den tidlige Jord. Imidlerti -
 Ædelmetalklynger kan forbedre ydeevnen af katalysatorer og spare ressourcerSkematisk fremstilling af en ædelmetalkatalysator med inaktive enkelte atomer (venstre) og aktive klynger (højre; ædelmetal:hvid; bæremetal:gul; oxygen:rød). Kredit:Florian Maurer, SÆT Milliarder
Ædelmetalklynger kan forbedre ydeevnen af katalysatorer og spare ressourcerSkematisk fremstilling af en ædelmetalkatalysator med inaktive enkelte atomer (venstre) og aktive klynger (højre; ædelmetal:hvid; bæremetal:gul; oxygen:rød). Kredit:Florian Maurer, SÆT Milliarder -
 At bryde reglerne:Tunge kemiske grundstoffer ændrer teorien om kvantemekanikThomas Albrecht-Schmitt er Gregory R. Choppin professor i kemi ved Florida State University. Kredit:Bill Lax/FSU Photography Services En række komplicerede eksperimenter, der involverer et af de m
At bryde reglerne:Tunge kemiske grundstoffer ændrer teorien om kvantemekanikThomas Albrecht-Schmitt er Gregory R. Choppin professor i kemi ved Florida State University. Kredit:Bill Lax/FSU Photography Services En række komplicerede eksperimenter, der involverer et af de m
- Kommunale obligationsrenter viser, at investorer er villige til at betale præmie for gæld, der adr…
- Nanopartikelbilleddannelse:En resonansforbedring
- Hvorfor går Pluto rundt om solen langsomt?
- Tre eksempler på protister med videnskabelige navne
- Tilskud, vejr, og finansiel uddannelse fremmer landbrugsforsikringsadoption
- Sådan køber du et hjem:7 tips til at forhandle som en professionel


