Hvordan NH4 NO2 NO3 Effekt pH i vand?
1. NH₄⁺ (ammoniumion)
* Syre: Ammoniumion (NH₄⁺) er den konjugerede syre af ammoniak (NH₃). Det hydrolyserer i vand, hvilket betyder, at det reagerer med vand for at frigive H⁺ioner:
`` `
NH₄⁺ (aq) + H₂O (L) ⇌ NH₃ (aq) + H₃O⁺ (aq)
`` `
* Effekt på pH: Produktionen af H₃O⁺ (hydroniumioner) gør opløsningen mere sur, hvilket sænker pH.
2. Ingen₂⁻ (nitrition)
* svagt grundlæggende: Nitrition (NO₂⁻) er den konjugerede base af nitrosyre (HNO₂). Det kan acceptere en proton fra vand, men i langt mindre grad end ammoniumion:
`` `
Ingen₂⁻ (aq) + h₂o (l) ⇌ hno₂ (aq) + oh⁻ (aq)
`` `
* Effekt på pH: Den lille produktion af OH⁻ (hydroxidioner) gør opløsningen lidt basisk, hvilket øger pH, men effekten er meget mindre udtalt end ammoniumionens surhed.
3. Ingen₃⁻ (nitration)
* neutral: Nitration (NO₃⁻) er den konjugerede base af salpetersyre (HNO₃). Kalpetersyre er imidlertid en meget stærk syre. Nitrationen er en så svag base, at den i det væsentlige ikke har nogen indflydelse på vandets pH.
samlet effekt:
* nh₄no₃ (ammoniumnitrat): Dette salt indeholder både ammoniumion (NH₄⁺) og nitration (NO₃⁻). Den sure virkning af ammoniumionen dominerer, hvilket resulterer i en sur opløsning.
* nh₄no₂ (ammonium nitrit): Dette salt indeholder både ammoniumion (NH₄⁺) og nitrition (NO₂⁻). Den sure virkning af ammoniumionen vil dominere, hvilket gør opløsningen sur , men effekten vil være lidt mindre udtalt end med ammoniumnitrat på grund af den svage basis af nitrit.
Vigtig note: De nøjagtige pH -værdier af disse opløsninger afhænger af saltens koncentrationer.
Sidste artikelHvad er symbolet for ammoniakopløsning?
Næste artikelSeparat svovl og sukker fra en blanding?
 Varme artikler
Varme artikler
-
 Tværfagligt team designer gasflowcelle til at analysere katalytisk adfærdMed hjælp fra andre forskere fra ORNL og Colorado State University, Daniel Olds og Katharine Page udviklede en gasstrømscelle med U-rør til at studere katalysatorer og bedre forstå, hvordan de letter
Tværfagligt team designer gasflowcelle til at analysere katalytisk adfærdMed hjælp fra andre forskere fra ORNL og Colorado State University, Daniel Olds og Katharine Page udviklede en gasstrømscelle med U-rør til at studere katalysatorer og bedre forstå, hvordan de letter -
 Forskere laver virusbekæmpende ansigtsmaskerGrafisk abstrakt. Kredit:ACS Applied Materials &Interfaces (2022). DOI:10.1021/acsami.2c04165 Forskere fra Rensselaer Polytechnic Institute har udviklet en tilgængelig måde at gøre N95-ansigtsmaske
Forskere laver virusbekæmpende ansigtsmaskerGrafisk abstrakt. Kredit:ACS Applied Materials &Interfaces (2022). DOI:10.1021/acsami.2c04165 Forskere fra Rensselaer Polytechnic Institute har udviklet en tilgængelig måde at gøre N95-ansigtsmaske -
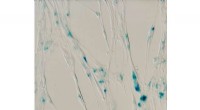 Celler holder op med at dele sig, når dette gen går i højt gear, undersøgelse finderÆldrende celler under et mikroskop. Cellerne - humane lungefibroblaster - blev ældre, efter at de eller nærliggende celler blev gensplejset til at øge aktiviteten af CD36-genet. Områder farvet med b
Celler holder op med at dele sig, når dette gen går i højt gear, undersøgelse finderÆldrende celler under et mikroskop. Cellerne - humane lungefibroblaster - blev ældre, efter at de eller nærliggende celler blev gensplejset til at øge aktiviteten af CD36-genet. Områder farvet med b -
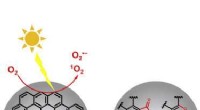 Partikelfasekemi gør det muligt for sod at spire skyer bedreMeget oxygenerede organiske molekyler med høj umættethed (HU-HOMer) dannes ved multigenerationel fotooxidation af store polycykliske aromatiske kulbrinter (PAHer) på sod. Kredit:Chem Meget oxygene
Partikelfasekemi gør det muligt for sod at spire skyer bedreMeget oxygenerede organiske molekyler med høj umættethed (HU-HOMer) dannes ved multigenerationel fotooxidation af store polycykliske aromatiske kulbrinter (PAHer) på sod. Kredit:Chem Meget oxygene
- Hvordan er elementerne i den første periodiske tabel arrangeret?
- Hvor er 70 grader nordlig breddegrad og 40 vestlig længdegrad?
- Hvor kommer energien, vi fra mange af vores naturressourcer i sidste ende kommer fra?
- Hvor mange elementer har to bogstaver i deres symbol?
- Hvordan er de indre og ydre lag af jorden forskellige?
- Undersøger en antropolog liv eller fysisk videnskab?


