Hvordan opfører ammoniumchlorid sig i vand?
1. Hydrolyse:
* Når ammoniumchlorid opløses i vand, adskiller det sig til ammoniumioner (NH₄⁺) og chloridioner (CL⁻).
* Ammoniumionen (NH₄⁺) gennemgår hydrolyse og reagerer med vandmolekyler for at danne hydroniumioner (H₃O⁺) og ammoniak (NH₃):
`` `
NH₄⁺ (aq) + H₂O (L) ⇌ H₃O⁺ (aq) + NH₃ (aq)
`` `
* Produktionen af hydroniumioner (H₃O⁺) er det, der gør opløsningen sur.
2. Chloridioner:
* Chloridioner (CL⁻) er den konjugerede base af en stærk syre (HCI). De er meget svage baser og bidrager ikke væsentligt til pH i opløsningen.
3. Samlet effekt:
* På grund af hydrolyse af ammoniumioner bliver opløsningen sur. PH af en ammoniumchloridopløsning vil være mindre end 7.
Andre egenskaber:
* Ammoniumchlorid er et hvidt krystallinsk fast stof, der er meget opløseligt i vand.
* Det bruges i forskellige anvendelser, herunder gødning, sprængstoffer og som fødevareadditiv.
Kortfattet:
Ammoniumchlorid opfører sig som et surt salt i vand, fordi ammoniumionerne gennemgår hydrolyse, producerer hydroniumioner og gør opløsningen sur.
 Varme artikler
Varme artikler
-
 Strækkende diamant til næste generations mikroelektronikStrækning af mikrofabricerede diamanter baner veje for applikationer inden for næste generations mikroelektronik. Kredit:Dang Chaoqun / City University of Hong Kong Diamant er det hårdeste materia
Strækkende diamant til næste generations mikroelektronikStrækning af mikrofabricerede diamanter baner veje for applikationer inden for næste generations mikroelektronik. Kredit:Dang Chaoqun / City University of Hong Kong Diamant er det hårdeste materia -
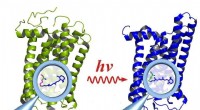 Ser komplekse molekyler på arbejdeRhodopsin før (venstre) og efter aktivering af lys (højre):Aktiveringen forårsager ændringer i funktionelle grupper inde i molekylet (forstørrelsesglas), som påvirker hele molekylet. Kredit:E. Ritter/
Ser komplekse molekyler på arbejdeRhodopsin før (venstre) og efter aktivering af lys (højre):Aktiveringen forårsager ændringer i funktionelle grupper inde i molekylet (forstørrelsesglas), som påvirker hele molekylet. Kredit:E. Ritter/ -
 Tre forskere vinder Nobelprisen i kemi for udviklingen inden for elektronmikroskopiEn revolutionerende teknik kaldet kryo-elektronmikroskopi, som har set nærmere på Zika -viruset og et Alzheimers enzym, tjente forskere Jacques Dubochet, Joachim Frank og Richard Henderson Nobels kemi
Tre forskere vinder Nobelprisen i kemi for udviklingen inden for elektronmikroskopiEn revolutionerende teknik kaldet kryo-elektronmikroskopi, som har set nærmere på Zika -viruset og et Alzheimers enzym, tjente forskere Jacques Dubochet, Joachim Frank og Richard Henderson Nobels kemi -
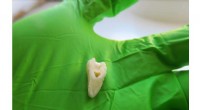 Super stærk, biokompatibelt materiale kan gøre ødelagte fyldninger til fortidenEn laboratorieforsker ordner fyldningen i en prøvetand. Kredit:KTH Kgl. Teknologisk Institut Snart behøver du måske ikke længere bekymre dig om, hvor længe dine tandreparationer vil vare. Et nyt d
Super stærk, biokompatibelt materiale kan gøre ødelagte fyldninger til fortidenEn laboratorieforsker ordner fyldningen i en prøvetand. Kredit:KTH Kgl. Teknologisk Institut Snart behøver du måske ikke længere bekymre dig om, hvor længe dine tandreparationer vil vare. Et nyt d
- Hvad er de 2 typer blandinger, og hvordan de er forskellige?
- Hvordan forbedrer solreflektorer effektiviteten af samler?
- Indeholder en kerne arvelighedsinfo?
- Hvorfor er skyerne orange om natten?
- Hvad er koordinaterne for Costa del Sol på et kort?
- Honda lukker fabrikken i Storbritannien i 2022, risikerer 3, 500 job:rapporter


