Hvad sker der med opløseligheden af calciumchlorid, hvis du køler opløsning?
* opløselighed og temperatur: Generelt øges opløseligheden af faste stoffer i væsker med temperaturen. Dette skyldes, at højere temperaturer giver mere energi til at bryde bindingerne, der holder det faste stof sammen, og lad det opløses bedre.
* Calciumchlorid Undtagelse: Selvom dette er en generel regel, er der undtagelser, og calciumchlorid er en af dem. Opløseligheden af calciumchlorid i vand falder faktisk, når temperaturen falder.
Hvorfor opfører calciumchlorid forskelligt?
Årsagen til denne opførsel er lidt kompleks og involverer termodynamikken i opløsningsprocessen. Her er en forenklet forklaring:
* opløsningsvarme: Opløsningen af calciumchlorid i vand er en eksoterm proces, hvilket betyder, at den frigiver varme. Dette betyder, at opløsningen bliver varmere, når calciumchlorid opløses.
* le Chateliers princip: I henhold til Le Chateliers princip vil et system i ligevægt skifte for at lindre stress. Når du afkøler opløsningen, tilføjer du stress til systemet. For at lindre denne stress skifter ligevægten mod dannelsen af uopløst calciumchlorid, hvilket reducerer dets opløselighed.
Kort sagt: Afkøling af en opløsning af calciumchlorid tvinger systemet til at favorisere dannelsen af fast calciumchlorid, hvilket fører til et fald i dets opløselighed.
 Varme artikler
Varme artikler
-
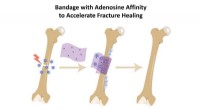 Knoglebandage opsuger pro-helende biokemiske for at fremskynde reparationenEn ny type knoglebandage fanger naturligt produceret adenosin tæt på bruddet, som fremmer og fremskynder helingen på stedet, før den langsomt frigiver adenosinen tilbage i kroppen. Kredit:Shyni Varghe
Knoglebandage opsuger pro-helende biokemiske for at fremskynde reparationenEn ny type knoglebandage fanger naturligt produceret adenosin tæt på bruddet, som fremmer og fremskynder helingen på stedet, før den langsomt frigiver adenosinen tilbage i kroppen. Kredit:Shyni Varghe -
 Identificeret:Molekylær struktur, der nedbryder en vigtig komponent i smogKredit:Pacific Northwest National Laboratory Kvælstofoxider, også kendt som NO x , dannes, når fossile brændstoffer brænder ved høje temperaturer. Når de udsendes fra industrielle kilder, såsom
Identificeret:Molekylær struktur, der nedbryder en vigtig komponent i smogKredit:Pacific Northwest National Laboratory Kvælstofoxider, også kendt som NO x , dannes, når fossile brændstoffer brænder ved høje temperaturer. Når de udsendes fra industrielle kilder, såsom -
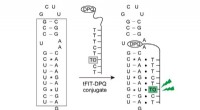 Ny måde at identificere influenza A-virus lyser op, når specifikke virusmål er til stedeSkematisk illustration af fluorescensføling af panhandle-strukturen af IAV RNA-promotorregionen (angivet i boksen). Kredit:tFIT-DPQ sonde. Influenza A-virus, som er ansvarlig for sæsonbestemte in
Ny måde at identificere influenza A-virus lyser op, når specifikke virusmål er til stedeSkematisk illustration af fluorescensføling af panhandle-strukturen af IAV RNA-promotorregionen (angivet i boksen). Kredit:tFIT-DPQ sonde. Influenza A-virus, som er ansvarlig for sæsonbestemte in -
 Ultrahurtig kompression tilbyder en ny måde at få makromolekyler ind i cellerneBilledet viser en mikrofluidisk chip, hvortil der er tilføjet farvestof for at vise kanalerne. Ved at behandle levende celler som små svampe, forskere har udviklet en potentielt ny måde at introducere
Ultrahurtig kompression tilbyder en ny måde at få makromolekyler ind i cellerneBilledet viser en mikrofluidisk chip, hvortil der er tilføjet farvestof for at vise kanalerne. Ved at behandle levende celler som små svampe, forskere har udviklet en potentielt ny måde at introducere


