Ultrahurtig kompression tilbyder en ny måde at få makromolekyler ind i cellerne

Billedet viser en mikrofluidisk chip, hvortil der er tilføjet farvestof for at vise kanalerne. Ved at behandle levende celler som små svampe, forskere har udviklet en potentielt ny måde at introducere makromolekyler og terapeutiske gener i menneskelige celler. Kredit:Rob Felt, Georgia Tech
Ved at behandle levende celler som små absorberende svampe, forskere har udviklet en potentielt ny måde at introducere molekyler og terapeutiske gener i menneskelige celler.
Teknikken komprimerer først celler i en mikrofluidisk enhed ved hurtigt at flyde dem gennem en række små "hastighedsbump" indbygget i mikrokanalerne, som komprimerer små mængder væske - kendt som cytosol - inde fra cellerne. Cellerne kommer så naturligt igen og fylder sig selv igen, suger omgivende væske op og trækker makromolekyler eller gener ind i det. Selvom de bratte kollisioner kan reducere cellevolumen med så meget som 30 procent, cellerne vender hurtigt tilbage, og mindre end fem procent af cellerne oplever tab af levedygtighed.
Den nye teknik er kendt som cellevolumenudveksling til konvektiv overførsel, eller celle VECT. Det menes at være den første kompressionsproces, der fremkalder meget forbigående cellevolumenudveksling ved at udnytte cellernes evne til at miste og hurtigt genvinde deres cytosol. Forskningen, som blev støttet af National Science Foundation, National Institutes of Health og Wallace H. Coulter Foundation, blev rapporteret online 17. april af tidsskriftet Materialer i dag .
"Vi udnytter en iboende mekanisk egenskab ved celler, " sagde Anna Liu, en ph.d. kandidat i laboratoriet hos lektor Todd Sulchek i Georgia Tech's Woodruff School of Mechanical Engineering. "Når celler pludselig komprimeres over en periode på mikrosekunder, de mister noget af deres volumen. Cellerne udveksler volumen med væsken omkring dem, og det er det, der giver dem mulighed for konvektivt at optage makromolekyler fra deres miljø."
Teknikken kan være nyttig til celletransfektion, hvor et målgen introduceres i menneskelige celler for at forårsage adfærd, som cellerne normalt ikke ville udvise, såsom ekspression af et protein. Der er en række eksisterende teknikker til at indføre genetisk materiale i levende celler, herunder brug af specialdesignede vira, men eksisterende teknikker har betydelige ulemper.
En bred vifte af terapeutiske og diagnostiske applikationer kan drage fordel af introduktion af store molekyler, som også kunne bruges som markører til kvalitetskontrolformål i cellefremstilling. "Der er mange grunde til at ønske at levere molekyler til det indre af celler, men der er ikke mange gode måder at gøre det på, " sagde Liu, der er National Science Foundation Graduate Research Fellow.
Forskerne opdagede kompressions- og volumenændringsfænomenerne, mens de udviklede teknikker til at sortere celler efter deres mekaniske egenskaber. I deres mikrofluidiske enheder, kompression tvang blødere celler til at bevæge sig i én retning, mens stivere celler tog en anden vej. Selvom forskningen fokuserede på opdagelse af kræft, det gav også en ny forståelse af, hvad der sker med celler, når de komprimeres hurtigt.
"Vores teknik afhænger slet ikke af makromolekylernes egenskaber for at udføre arbejdet, " Liu forklarede. "Aktiviteten er alt forårsaget af den konvektive tilstrømning af væskevolumen tilbage i cellerne. Molekylerne i væsken er lige med på turen, som giver os mulighed for at overføre molekyler uden hensyn til deres størrelse eller egenskaber."
Kompressionshastigheden er kritisk. Hvis celler undergår komprimering over længere perioder, de kan deformeres gradvist og bevare deres volumen. Hele celle VECT-komprimering og afslapningsprocessen tager millisekunder, får cellerne til at deformere pludseligt uden at bevare volumen. Alligevel har processen ringe eller ingen effekt på cellernes levedygtighed. "Vi har lavet en række tests for at se, om cellelevedygtighed, funktion og genekspression ændres, og vi har ikke set nogen væsentlige forskelle, " sagde Liu.
Forskerne har undersøgt en bred vifte af menneskelige celletyper, fra prostatacancer til leukæmiceller, og endda primære T-celler. De begyndte med at levere et polysaccharid, dextran, og fulgt op med proteiner, RNA og plasmider. For at udforske teknikkens grænser, de brugte celle VECT til at flytte 100 nanometer partikler ind i celler.
Ud over at overføre terapeutiske og diagnostiske makromolekyler, som nu er svære at indføre i celler, teknikken kunne tillade større makromolekyler at blive leveret til celler, åbner nye muligheder for celleteknik og terapier.

Forskere har udviklet en potentielt ny måde at introducere makromolekyler og terapeutiske gener i menneskelige celler. Vist er National Science Foundation Graduate Research Fellow Anna Liu. Kredit:Rob Felt, Georgia Tech
"Cell VECT betyder, at vi ikke længere er begrænset af størrelsen af den last, som en virus kan bære, " sagde Alexander Alexeev, en lektor i Woodruff School of Mechanical Engineering og en samarbejdspartner på forskningen. "Dette kan åbne en ny måde for forskere at konstruere levende celler ved hjælp af mere komplekse molekyler. Laststørrelse ville ikke længere være et kritisk problem."
Ved at indføre mærkningsmolekyler i celler, celle-VECT-teknikken kunne også give en pålidelig og reproducerbar kvalitetskontrolteknik til fremstilling af processer, der genererer terapeutiske celler, Sulchek bemærkede.
I det fremtidige arbejde, forskerne planlægger at udvikle en bedre forståelse af, hvordan teknikken virker, studere parametrene for processen - og observer celler over lange perioder for at sikre, at der ikke er nogen skadelige virkninger.
"Der er stadig en grundlæggende videnskabelig forståelse, som vi skal udvikle, " sagde Sulchek. "Vi vil gerne karakterisere, hvad der forlader cellerne, og under hvilke forhold de rejser. Vi vil gerne vide, hvor hurtigt tingene vender tilbage, hvad er begrænsningerne for denne tilbagevenden, og hvor de går hen i cellen, når de vender tilbage."
Sidste artikelDobbeltbroede peptider binder ethvert sygdomsmål
Næste artikelEn ny formel til at skabe kemiske reaktioner - med kulhydrater
 Varme artikler
Varme artikler
-
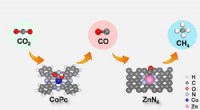 Tandemkatalysator til forbedring af kuldioxidelektroreduktion til metanCO2 reduceres først elektrokemisk til CO og derefter diffunderer CO til Zn-N-C for yderligere omdannelse til CH 4 over CoPc@Zn-N-C tandemkatalysator. Kredit:LIN Long og LIU Tianfu Kuldioxidreduk
Tandemkatalysator til forbedring af kuldioxidelektroreduktion til metanCO2 reduceres først elektrokemisk til CO og derefter diffunderer CO til Zn-N-C for yderligere omdannelse til CH 4 over CoPc@Zn-N-C tandemkatalysator. Kredit:LIN Long og LIU Tianfu Kuldioxidreduk -
 Hvad er en forbrændingsreaktion?En forbrændingsreaktion, undertiden forkortet RXN, er enhver reaktion, hvor et brændbart materiale kombineres med ilt eller oxideres. Den mest almindelige forbrændingsreaktion er en brand, hvor kul
Hvad er en forbrændingsreaktion?En forbrændingsreaktion, undertiden forkortet RXN, er enhver reaktion, hvor et brændbart materiale kombineres med ilt eller oxideres. Den mest almindelige forbrændingsreaktion er en brand, hvor kul -
 Nanokapsler muliggør celleinspirerede metaboliske reaktionerSkematisk illustration af det biokatalytiske nanorum med indkapslet enzym phosphoglucomutase til omdannelse af glucose-1-phosphat (blå cirkler) til det ønskede produkt glucose-6-phosphat (orange cirkl
Nanokapsler muliggør celleinspirerede metaboliske reaktionerSkematisk illustration af det biokatalytiske nanorum med indkapslet enzym phosphoglucomutase til omdannelse af glucose-1-phosphat (blå cirkler) til det ønskede produkt glucose-6-phosphat (orange cirkl -
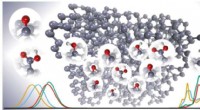 Skræddersyet kulstof kan hjælpe forskere med at finde arvelige sygdomme og de rigtige doser af med…Den nye metode gør det muligt at opdele det eksperimentelle spektrum produceret ved røntgenspektroskopi i data på atomniveau. Kredit:Anja Aarva / Aalto University Sensorer fremstillet med kulstofb
Skræddersyet kulstof kan hjælpe forskere med at finde arvelige sygdomme og de rigtige doser af med…Den nye metode gør det muligt at opdele det eksperimentelle spektrum produceret ved røntgenspektroskopi i data på atomniveau. Kredit:Anja Aarva / Aalto University Sensorer fremstillet med kulstofb
- SDO afslører, hvordan magnetisk bur på solen stoppede soludbrud
- En smart blød ortose for en stærkere ryg
- Guldkatalyseret reaktion frigiver et aktivt lægemiddel til at dræbe kræftceller
- Majs, ikke metal, nøglen til indfødte bosættelseshistorie i NY
- Stoffer, der er uigennemtrængelige for vand
- Hvordan magtafstandstro påvirker forbrugernes prisfølsomhed


