Dobbeltbroede peptider binder ethvert sygdomsmål
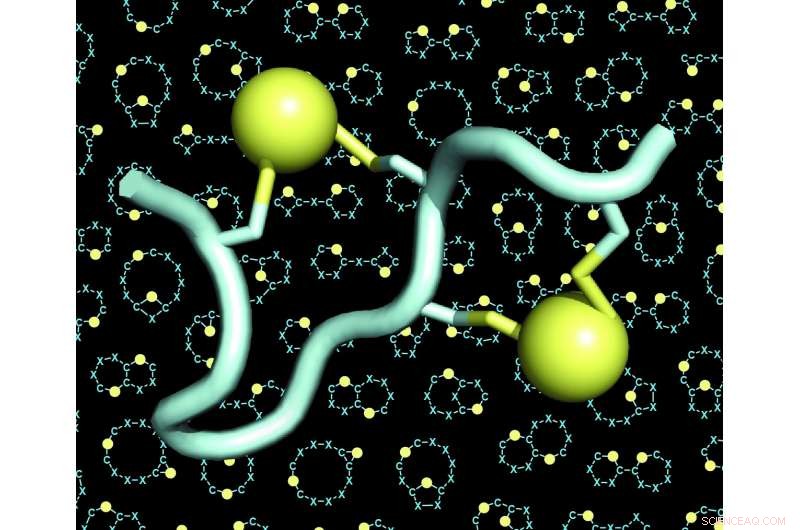
En model af et dobbeltbrokoblet peptid (peptidet i lyseblåt, de to broer i gult). Baggrunden for figurerne viser mange eksempler på skeletter (også kaldet 'stilladser' eller 'rygrade') af dobbeltbroforbundne peptider. Kredit:C. Heinis/EPFL
Peptider er korte kæder af aminosyrer, der kan binde sig til proteiner og ændre deres funktion. De viser høj bindingsaffinitet, lav toksicitet, og er nemme at syntetisere, alt dette gør peptider ideelle til brug i lægemiddeludvikling, og mange naturligt forekommende peptider såsom insulin, oxytocin, somatostatin og antibiotika vancomycin eller polymyxin B, er meget brugt.
Imidlertid, at bruge peptider som lægemidler står over for to udfordringer. Først, bindingsaffinitet:God binding kræver vanskelige peptidarkitekturer og aminosyresekvenser, som er perfekt komplementære i form og ladning til overfladen af deres målproteiner. Sekund, peptidstabilitet:peptider kan potentielt skæres af enzymer (proteaser) til mindre, ubrugelige fragmenter eller endda enkelte aminosyrer.
Laboratoriet af Christian Heinis på EPFL har nu adresseret begge disse udfordringer ved at udvikle det nye peptidformat, som de kalder "dobbeltbroede peptider." Disse er kæder på 10 til 15 aminosyrer, hvoraf fire er kemisk forbundet med to broer. Hver bro forbinder et par af to cysteinaminosyrer - fire i alt.
Fordi de fire cysteiner kan placeres i mange forskellige konfigurationer langs sekvensen af aminosyrer, dobbeltbrostrategien gjorde det muligt for forskerne at generere et enormt stort antal strukturelt forskellige peptidarkitekturer. De udvidede mangfoldigheden yderligere ved at bruge forskellige kemiske reagenser, der øgede antallet af broer. Forskerne fandt også ud af, at de fire cysteiner kunne bygges bro af to linkere på tre forskellige måder, giver anledning til tre forskellige arkitekturer fra hver enkelt peptidsekvens.
Ved at bruge denne strategi, forskerne producerede en enorm mangfoldighed af peptidstrukturer, alle med forskellige "skelet" strukturer. Ud over, kemikerne ændrede systematisk aminosyrerne mellem cysteinerne og genererede biblioteker af milliarder af forskellige dobbeltbroede peptider. Efter gennemgang af bibliotekerne, forskerne var i stand til at isolere bindemidler med høj affinitet til vigtige proteinmål. Et af disse mål var kallikrein, et plasmaprotein, der er forbundet med arvelig angioødem, en sjælden hævelseslidelse. En anden var interleukin-17, et cytokinprotein, der er involveret i flere inflammatoriske lidelser såsom leddegigt og psoriasis. Ved at bruge dobbeltbro-tilgangen til begge disse proteinmål, forskerne udviklede peptider, der kunne binde dem effektivt ved nanomolære koncentrationer. I tilfælde af kallikrein, peptiderne kunne binde det i mere end en time, før de dissocierede.
Stabilitet var også et yderst attraktivt træk ved det nye peptidformat. De dobbeltbroede peptider nedbrydes næsten ikke af proteaser i blodet, hvilket er en stor fordel, fordi det forhindrer peptiderne i at blive elimineret for hurtigt, dermed udvide deres terapeutiske virkninger.Baseret på resultaterne, Heinis' laboratorium anvender nu peptidformatet til mange andre sygdomsmål. De har allerede udviklet nye, endnu større dobbeltbroforbundne peptidbiblioteker og screenede dem mod en række sygdomsrelevante mål. Et af disse peptider er allerede under præklinisk evaluering.
 Varme artikler
Varme artikler
-
 Solcellemateriale klarer sig bedre under trykAdskillelse af bromid og iodid i perovskitter resulterer i et inhomogent energilandskab, afbildet som bakker og dale. Ved højt tryk, jodidet og bromidet forbliver homogent fordelt, så perovskitterne b
Solcellemateriale klarer sig bedre under trykAdskillelse af bromid og iodid i perovskitter resulterer i et inhomogent energilandskab, afbildet som bakker og dale. Ved højt tryk, jodidet og bromidet forbliver homogent fordelt, så perovskitterne b -
 En ny metode til 3-D-udskrivning af levende vævBillede af 3D-dråbe bioprinteren, udviklet af Bayley Research Group i Oxford, producerer væv i mm Kredit:Sam Olof/ Alexander Graham Forskere ved University of Oxford har udviklet en ny metode til
En ny metode til 3-D-udskrivning af levende vævBillede af 3D-dråbe bioprinteren, udviklet af Bayley Research Group i Oxford, producerer væv i mm Kredit:Sam Olof/ Alexander Graham Forskere ved University of Oxford har udviklet en ny metode til -
 Fra gerningsstedet til retssalen - en DNA -prøves rejsePolitiet skal sikre, at prøver ikke er forurenet. Kredit:James Hereward og Caitlin Curtis, Forfatter angivet O.J. Simpson-mordssagen i 1995 introducerede DNA-kriminalteknik for offentligheden. Sag
Fra gerningsstedet til retssalen - en DNA -prøves rejsePolitiet skal sikre, at prøver ikke er forurenet. Kredit:James Hereward og Caitlin Curtis, Forfatter angivet O.J. Simpson-mordssagen i 1995 introducerede DNA-kriminalteknik for offentligheden. Sag -
 Jagten på bæredygtige læderalternativerKredit:Pixabay/CC0 Public Domain Igennem historien, læder har været et populært materiale til tøj og mange andre varer. Imidlertid, garvningsprocessen og brugen af husdyr betyder, at den har et
Jagten på bæredygtige læderalternativerKredit:Pixabay/CC0 Public Domain Igennem historien, læder har været et populært materiale til tøj og mange andre varer. Imidlertid, garvningsprocessen og brugen af husdyr betyder, at den har et
- Mere end halvdelen af byggebranchens insidere mener, at industrien ikke er bæredygtig, undersøge…
- Letpresser reducerer kvantestøj i lasere, kunne forbedre kvanteberegning og gravitationsbølgedetek…
- De to kræfter, der holder planeterne i bevægelse omkring solen
- Kinas tunge løfteraketaffyring mislykkes:statslige medier
- Opfanger lys:Ny ergonomisk fotodetektor til trillionsensor-æraen
- Præcis definerede polymerkæder er nu en realitet


