Hvorfor er CO2 -gas og CS2 væske?
* CO2 (kuldioxid):
* CO2 er et lineært molekyle med to polære C =O -bindinger. Molekylet er imidlertid ikke -polær Fordi bondedipolerne annullerer hinanden.
* De dominerende intermolekylære kræfter i CO2 er svage London Dispersion Forces . Disse kræfter er relativt svage, fordi molekylet er lille og ikke -polært.
* Som et resultat eksisterer CO2 som en gas ved stuetemperatur.
* CS2 (carbon disulfid):
* CS2 er også et lineært molekyle med to polære C =S -bindinger. Molekylet er imidlertid polar Fordi bondedipolerne ikke helt annullerer hinanden.
* Foruden London-spredningskræfter udviser CS2 også dipol-dipol-interaktioner På grund af dens polære karakter. Disse kræfter er stærkere end London -spredningskræfter.
* De stærkere intermolekylære kræfter i CS2 fører til et højere kogepunkt, og det findes derfor som en væske ved stuetemperatur.
Andre faktorer:
* molekylvægt: CS2 har en højere molekylvægt end CO2, som også bidrager til stærkere intermolekylære kræfter.
* polariserbarhed: Svovlatomer er mere polariserbare end iltatomer, hvilket fører til stærkere London -spredningskræfter i CS2.
Sammenfattende resulterer de stærkere intermolekylære kræfter i CS2 på grund af dens polære natur og højere molekylvægt i et højere kogepunkt og en flydende tilstand ved stuetemperatur, i modsætning til CO2, der findes som en gas på grund af dens svage intermolekylære kræfter.
 Varme artikler
Varme artikler
-
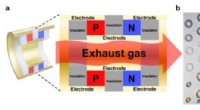 En termoelektrisk blæk, der gør bilens udstødningsrør til kraftgeneratorer3D-print af kraftproducerende TE-rør. a) Skema, der viser det kraftgenererende TE-rør fremstillet af 3D-printede p-type og n-type PbTe-rør forfra. b) Foto, der viser komponenterne til modulets samling
En termoelektrisk blæk, der gør bilens udstødningsrør til kraftgeneratorer3D-print af kraftproducerende TE-rør. a) Skema, der viser det kraftgenererende TE-rør fremstillet af 3D-printede p-type og n-type PbTe-rør forfra. b) Foto, der viser komponenterne til modulets samling -
 Menneskelige farer hæmmer forskning i vampyrflagermusgiftKredit:University of Queensland Vampyrflagermus kan holde nøglen til nye behandlinger for en række alvorlige medicinske problemer, men forskere har ramt en hage ved at få adgang til de prøver, der
Menneskelige farer hæmmer forskning i vampyrflagermusgiftKredit:University of Queensland Vampyrflagermus kan holde nøglen til nye behandlinger for en række alvorlige medicinske problemer, men forskere har ramt en hage ved at få adgang til de prøver, der -
 Et mere modstandsdygtigt materiale mod mikroorganismer skabes for at genoprette kulturarvenUndersøgelsen blev udført af et forskerhold ved universitetets forskningsinstitut i finkemi og nanokemi ved universitetet i Cordoba og Sevillas institut for naturressourcer og agrobiologi fra det span
Et mere modstandsdygtigt materiale mod mikroorganismer skabes for at genoprette kulturarvenUndersøgelsen blev udført af et forskerhold ved universitetets forskningsinstitut i finkemi og nanokemi ved universitetet i Cordoba og Sevillas institut for naturressourcer og agrobiologi fra det span -
 Ny analyse finder en ny mekanisme bag ældning af røde blodlegemerKredit:CC0 Public Domain Røde blodlegemer er den hyppigst forekommende celletype i blodet, transporterer ilt gennem hele menneskekroppen. I blodcirkulationen, de støder gentagne gange på forskelli
Ny analyse finder en ny mekanisme bag ældning af røde blodlegemerKredit:CC0 Public Domain Røde blodlegemer er den hyppigst forekommende celletype i blodet, transporterer ilt gennem hele menneskekroppen. I blodcirkulationen, de støder gentagne gange på forskelli
- Hvilken planet har en måne kaldet Sharon?
- Oplysninger om naturgas
- I kølvandet på Equifax-brud, hvad du skal gøre, skal du beskytte dine oplysninger
- Bevis på TB-lignende infektion fundet i 245 millioner år gammelt havkrybdyr
- Hvor går produkter af forbrændte kulbrinter?
- Plast i havene er ikke det globale syds skyld


