Ender alle baser med hydroxid?
Mens hydroxid er en almindelig komponent i mange baser, især dem, der er opløst i vand (kaldet Arrhenius -baser), er der andre typer baser:
* Brønsted-lowry baser: Disse baser accepterer protoner (H+). De behøver ikke nødvendigvis at indeholde hydroxid. Eksempler inkluderer ammoniak (NH3) og carbonationer (CO32-).
* Lewis -baser: Disse baser donerer elektronpar. Mange Lewis -baser indeholder ikke hydroxid. Eksempler inkluderer aminer (som ammoniak) og ethere.
for at opsummere:
* Arrhenius baser: Indehold altid hydroxid (OH-)
* Brønsted-lowry baser: Kan indeholde hydroxid, men også andre grupper, der kan acceptere protoner.
* Lewis -baser: En lang række forbindelser, mange uden hydroxid.
Så selvom hydroxid er et almindeligt kendetegn ved baser, er det ikke et krav for dem alle.
Sidste artikelHvor mange atomer er der i 1,5 mol calcium?
Næste artikelHvad er udtryk kan være en kemisk forbindelse?
 Varme artikler
Varme artikler
-
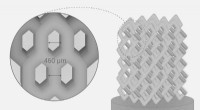 Forskere udviklede en ny metode til fremstilling af knogleimplantaterKnogleimplantat. Kredit:Pavel Odinev / Skoltech Forskere fra Skoltech Center for Design, Fremstilling, and Materials (CDMM) har udviklet en metode til at designe og fremstille kompleksformede kera
Forskere udviklede en ny metode til fremstilling af knogleimplantaterKnogleimplantat. Kredit:Pavel Odinev / Skoltech Forskere fra Skoltech Center for Design, Fremstilling, and Materials (CDMM) har udviklet en metode til at designe og fremstille kompleksformede kera -
 Hæmmer eller fremmer zink vækst af nyresten? Godt, beggeKredit:CC0 Public Domain Der skete en sjov ting på vejen til at opdage, hvordan zink påvirker nyresten - to forskellige teorier dukkede op, hver modsiger hinanden. Et:Zink stopper væksten af de
Hæmmer eller fremmer zink vækst af nyresten? Godt, beggeKredit:CC0 Public Domain Der skete en sjov ting på vejen til at opdage, hvordan zink påvirker nyresten - to forskellige teorier dukkede op, hver modsiger hinanden. Et:Zink stopper væksten af de -
 Forskere skaber fotoniske materialer til kraftfuld, effektiv lysbaseret databehandlingKredit:CC0 Public Domain Forskere fra University of Central Florida udvikler nye fotoniske materialer, der en dag kan hjælpe med at muliggøre laveffekt, ultrahurtig, lys-baseret databehandling. De
Forskere skaber fotoniske materialer til kraftfuld, effektiv lysbaseret databehandlingKredit:CC0 Public Domain Forskere fra University of Central Florida udvikler nye fotoniske materialer, der en dag kan hjælpe med at muliggøre laveffekt, ultrahurtig, lys-baseret databehandling. De -
 3D-blæk, der kan slettes selektivtTredimensionelle mikrostrukturer lavet af forskellige spaltbare fotoresister. Scanningselektronmikroskopierne viser den selektive nedbrydning af strukturerne (skalering på 20 µm). Kredit:Nature Commun
3D-blæk, der kan slettes selektivtTredimensionelle mikrostrukturer lavet af forskellige spaltbare fotoresister. Scanningselektronmikroskopierne viser den selektive nedbrydning af strukturerne (skalering på 20 µm). Kredit:Nature Commun
- Hvor mange valenselektroner har elementet strontium SR?
- Forskellen mellem anafase, interfase, metafase og profase
- Hvilken type energi frigiver drivhusgasser, når de bruges til at fremstille elektricitet?
- Et klarere billede af, hvordan assassin bugs udviklede sig
- Hvad er det højeste bjerg i Appalachian rækkevidde?
- Undersøgelse opfordrer til, at moralske såvel som sociale værdier tages i betragtning i rugbyudvæ…


