Hvad er formlen for sammensat disulfur pentachlorid?
Her er hvorfor:
* svovl og klor danner forskellige forbindelser. De mest almindelige forbindelser dannet af svovl og klor er svovldichlorid (SCL₂) og svovl -tetrachlorid (SCL₄).
* "Disulfur" foreslår to svovlatomer. I de typiske forbindelser dannet med svovl og klor er der imidlertid kun et svovlatom pr. Molekyle.
mulige fejlagtige fortolkninger:
* disulfur dichloride (s₂cl₂): Denne forbindelse findes og kaldes undertiden "svovlmonochlorid" (for ikke at forveksle med svovlmonochlorid, en anden forbindelse).
* svovl pentachlorid (SCL₅): Denne forbindelse findes ikke i stabil form. Svovl kan kun danne maksimalt fire bindinger på grund af dens elektronkonfiguration.
for at opsummere: Mens "disulfur pentachlorid" kan virke som en gyldig formel, svarer det ikke til nogen kendt stabil kemisk forbindelse.
Sidste artikelHvad er den kemiske formel for tin II -fosfat?
Næste artikelHvor mange atomer er der i 1,5 mol calcium?
 Varme artikler
Varme artikler
-
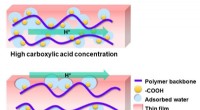 Protoners rejsevej i polymerer kan føre til rene brændstofferSkematisk repræsentation af afhængigheden af hovedprotontransportvejen i tynde polymerfilm af carboxylsyregruppekoncentrationen. Kredit:Yuki Nagao Protoner - subatomære partikler med en positiv
Protoners rejsevej i polymerer kan føre til rene brændstofferSkematisk repræsentation af afhængigheden af hovedprotontransportvejen i tynde polymerfilm af carboxylsyregruppekoncentrationen. Kredit:Yuki Nagao Protoner - subatomære partikler med en positiv -
 Forvandling af stamceller til knogler med nanolerforstærket hydrogelKredit:CC0 Public Domain Adjunkt Alireza Dolatshahi-Pirouz og kolleger har udviklet en hydrogel, der kombinerer syntetiske materialer med levende celler, og kan omdanne stamceller til knogler uden
Forvandling af stamceller til knogler med nanolerforstærket hydrogelKredit:CC0 Public Domain Adjunkt Alireza Dolatshahi-Pirouz og kolleger har udviklet en hydrogel, der kombinerer syntetiske materialer med levende celler, og kan omdanne stamceller til knogler uden -
 Forskere udvikler hybrid meta-biomateriale, der kan forlænge levetiden af hofteimplantater3D-printet hofteimplantat udviklet ved hjælp af det nye hybride meta-biomateriale. Kredit:TU Delft Et hybrid meta-biomateriale, der fremmer knoglevækst, er ikke noget, du finder i naturen, men det
Forskere udvikler hybrid meta-biomateriale, der kan forlænge levetiden af hofteimplantater3D-printet hofteimplantat udviklet ved hjælp af det nye hybride meta-biomateriale. Kredit:TU Delft Et hybrid meta-biomateriale, der fremmer knoglevækst, er ikke noget, du finder i naturen, men det -
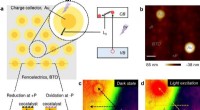 Forskere foreslår ny ladningsadskillelsesstrategi i ferroelektriske fotokatalysatorerLadningsadskillelse ved meta/ferroelektrisk grænseflade. et skematisk diagram af foreslået metal/ferroelektrisk fotokatalysator. b AFM-topografi af Au-partikler på en BaTiO3 enkelt krystal. Målestok,
Forskere foreslår ny ladningsadskillelsesstrategi i ferroelektriske fotokatalysatorerLadningsadskillelse ved meta/ferroelektrisk grænseflade. et skematisk diagram af foreslået metal/ferroelektrisk fotokatalysator. b AFM-topografi af Au-partikler på en BaTiO3 enkelt krystal. Målestok,
- Video:Rumaffald - en rejse til Jorden
- Hvordan blev videnskab anvendt i opfindelsen af VCR?
- Hvid rådsvampes størrelse forklares ved bredden af involverede genfamilier
- Global undersøgelse viser, at en tredjedel flere insekter kommer ud efter mørkets frembrud
- Hvad er tærskelhastighed?
- Hvordan det at blive opsagt påvirkede folks følelse af tid og forhold til arbejdet


