En opløsning indeholdende 14 gram AGNO3 tilsættes til en 4,83 g CaCl2. Find massen bundfaldet.?
1. Skriv den afbalancerede kemiske ligning:
Reaktionen mellem sølvnitrat (Agno₃) og calciumchlorid (CaCl₂) producerer sølvchlorid (AgCl) bundfald og calciumnitrat (Ca (No₃) ₂):
2 Agno₃ (aq) + cacl₂ (aq) → 2 AGCL (s) + CA (no₃) ₂ (aq)
2. Beregn molen for hver reaktant:
* agno₃:
* Molmasse af agno₃ =169,87 g/mol
* Mol Agno₃ =14 g / 169,87 g / mol =0,0824 mol
* cacl₂:
* Molmasse cacl₂ =110,98 g/mol
* Mol cacl₂ =4,83 g / 110,98 g / mol =0,0435 mol
3. Bestem den begrænsende reaktant:
Den begrænsende reaktant er den, der bliver fortæret helt først, hvilket begrænser mængden af dannet produkt.
* Fra den afbalancerede ligning reagerer 2 mol Agno₃₃ med 1 mol cacl₂.
* Molforholdet mellem agno₃ og cacl₂ er 2:1.
* Vi har 0,0824 mol Agno₃, hvilket ville kræve 0,0824 mol / 2 =0,0412 mol cacl₂.
* Da vi har mere cacl₂ (0,0435 mol) end nødvendigt, er Agno₃ den begrænsende reaktant.
4. Beregn molen af bundfaldet (AGCL):
* Fra den afbalancerede ligning producerer 2 mol Agno₃ 2 mol AGCl.
* Molforholdet mellem agno₃ og AGCL er 1:1.
* Derfor vil 0,0824 mol Agno₃ producere 0,0824 mol AgCl.
5. Beregn massen af bundfald (AGCL):
* Molmasse AgCl =143,32 g/mol
* Masse AgCl =0,0824 mol * 143,32 g/mol =11,78 g
Derfor er massen af bundfaldet (AGCL) produceret ca. 11,78 gram
Sidste artikelHvad er navnet på sammensat B2H4?
Næste artikelHvilken type binding er fluor og blyform?
 Varme artikler
Varme artikler
-
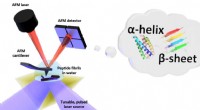 Formen i vand:Første nanoskalamålinger af biomolekylefoldning i væskeSkematisk af opsætningen for fototermisk induceret resonans (PTIR), som inkluderer en infrarød laserkilde og atomic force microscope (AFM) cantilever med en skarp spids, der rører prøven og vibrerer s
Formen i vand:Første nanoskalamålinger af biomolekylefoldning i væskeSkematisk af opsætningen for fototermisk induceret resonans (PTIR), som inkluderer en infrarød laserkilde og atomic force microscope (AFM) cantilever med en skarp spids, der rører prøven og vibrerer s -
 Forskere kigger ind i vandklyngedatabasen, tognetværk til at forudsige energilandskaberPNNL -forskere brugte 500, 000 vandklynger fra en nyligt udviklet database med over 5 millioner vandklynge -minima til at træne et neuralt netværk, der er afhængig af den matematiske kraft i grafteori
Forskere kigger ind i vandklyngedatabasen, tognetværk til at forudsige energilandskaberPNNL -forskere brugte 500, 000 vandklynger fra en nyligt udviklet database med over 5 millioner vandklynge -minima til at træne et neuralt netværk, der er afhængig af den matematiske kraft i grafteori -
 Magnesium tager FORMPNNLs Shear Assisted Processing and Extrusion™, eller FORM, teknologi. Kredit:Andrea Starr /Pacific Northwest National Laboratory To former for magnesiummateriale, der blev forarbejdet til rør ved
Magnesium tager FORMPNNLs Shear Assisted Processing and Extrusion™, eller FORM, teknologi. Kredit:Andrea Starr /Pacific Northwest National Laboratory To former for magnesiummateriale, der blev forarbejdet til rør ved -
 Hvordan fælles elementer kan gøre en mere energisikker fremtidEt epitaxy-system med molekylær stråle lægger hvert atomlag af forbindelsen ned systematisk, så forskere kan studere det tynde lag, eller film, struktur, når de vokser den. Kredit:Durbin Lab Tyndf
Hvordan fælles elementer kan gøre en mere energisikker fremtidEt epitaxy-system med molekylær stråle lægger hvert atomlag af forbindelsen ned systematisk, så forskere kan studere det tynde lag, eller film, struktur, når de vokser den. Kredit:Durbin Lab Tyndf
- 1,5 C opvarmningsgrænse umulig uden større handling:FN
- Hvornår nåede Apollo 13 månen?
- Hvilke færdigheder får du fra videnskaben?
- Hvor i den eukaryotiske celle forekommer RNA -behandling og translation til replikationstranskriptio…
- Simpelt kobber bliver en effektiv spintronisk komponent takket være molekylær film
- Sådan beregnes den dag jeg var Born


