Formen i vand:Første nanoskalamålinger af biomolekylefoldning i væske
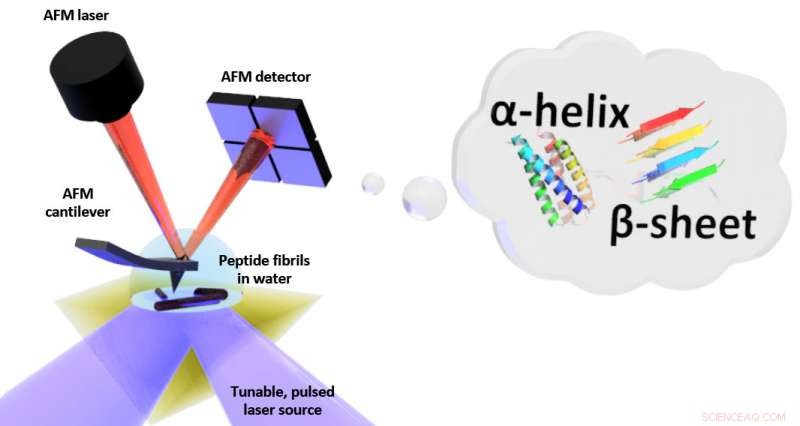
Skematisk af opsætningen for fototermisk induceret resonans (PTIR), som inkluderer en infrarød laserkilde og atomic force microscope (AFM) cantilever med en skarp spids, der rører prøven og vibrerer som reaktion på prøvens lys-inducerede ekspansion. PTIR kan bestemme foldemønsteret (kaldes f.eks. Α-helix, β-sheet) af peptider (aminosyrekæder) i vand med opløsning i nanometerskala. Kredit:NIST
De har været med til at udvikle en metode de sidste par år, forskere har for første gang målt på nanometerskalaen de karakteristiske mønstre af folder, der giver proteiner deres tredimensionelle form i vand. Udviklet af forskere ved National Institute of Standards and Technology (NIST) og deres kolleger, denne teknik vil hjælpe videnskabsmænd med at få indsigt i biomolekylers adfærd i vandige miljøer, der ligner dem i celler. Disse indsigter, på tur, kunne øge vores forståelse af store sygdomme, herunder Alzheimers, der er relateret til "fejl" i proteinfoldning.
Livet, som vi kender det, kunne ikke overleve, hvis proteiner ikke foldede sig ind i præcise mønstre, der førte til helixer, ark og andre former, der giver proteiner deres tredimensionelle struktur. De præcise former for proteiner gør det muligt for dem at transportere ilt, afværge skadelige bakterier og udføre andre vigtige opgaver i kroppen. Proteiner, der folder forkert, kan ikke fungere og genererer nogle gange giftige fragmenter, såsom dem, der er forbundet med neurodegenerative lidelser.
For at forstå forviklingerne ved at folde, forskere skal undersøge det detaljerede arrangement af kæder af aminosyrer, der er kortere og enklere end proteiner - kaldet peptider - og hvordan de foldes, samles og roteres for at skabe en række forskellige former, eller konformationer. Biologer foretrækker at undersøge proteiner og peptider nedsænket i vand, fordi det miljø nærmer sig forholdene inde i levende celler.
Tidligere etablerede teknikker til at bestemme konformationen af proteiner, såsom infrarød spektroskopi, mangler den fine rumlige opløsning for at studere de små og forskelligartede samlinger af korrekt foldede og fejlfoldede proteiner. Ud over, disse teknikker fungerer ikke godt i et vandigt miljø, fordi vand kraftigt absorberer infrarødt lys, forvirrer analysen. Vand havde også stillet store udfordringer for en banebrydende teknik, kendt som fototermisk induceret resonans (PTIR), som for nylig gjorde det muligt for forskere at undersøge peptidstruktur og konformation i luft med opløsning i nanoskala.
NIST-forskere og deres kolleger har nu vist, at PTIR kan tilpasses til at opnå konformationel struktur på nanoskala i vand ved hjælp af to kemisk lignende peptider kendt som diphenylalanin og Boc-diphenylalanine. Diphenylalanin er relateret til beta-amyloid, en klæbrig, større peptid forbundet med Alzheimers sygdom.
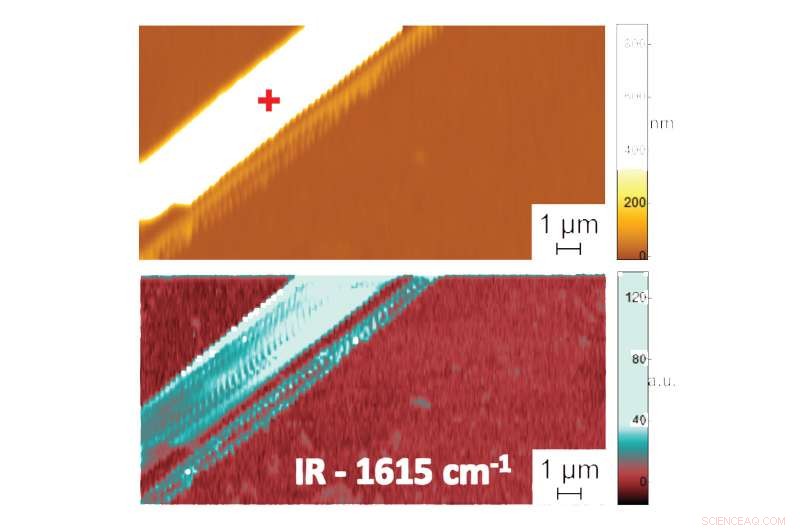
Vises i:The Shape in Water:First Nanometer-Scale Measurements of the Folded Structure of Biomolecules in Liquids. Atomic force-mikroskopbillede, der viser topografi (øverst) og PTIR-absorptionsbillede, der indikerer sammensætning og konformation (nederst) af en diphenylalanin-peptidfibril i vand. Yderligere data, registrering af spektret af infrarød stråling absorberet af peptidfibrillerne, giver oplysninger om deres foldemønster. PTIR-spektret viste, for eksempel, at diphenylalanin antager en ren anti-parallel β-ark-konformation. Kredit:NIST
"PTIR er en kraftfuld teknik, der allerede havde vist lovende for studier af biologiske systemer, men muligheden for at bruge dette med prøver i et flydende miljø vil i høj grad forbedre dets anvendelse i dette område, " sagde Georg Ramer fra NIST og University of Maryland i College Park. Ramer og NIST-forsker Andrea Centrone, sammen med deres kolleger ved University of Cambridge i England, beskrev deres arbejde i en artikel, der for nylig blev lagt online på ACS Nano .
PTIR bestemmer den kemiske sammensætning af materialer med nanoskalaopløsning ved at kombinere et atomkraftmikroskop (AFM) med lys fra en infrarød laser, der opererer over en række bølgelængder. De karakteristiske bølgelængder af infrarødt lys, der absorberes af prøven, svarer til et molekylært fingeraftryk, afsløre dens kemiske sammensætning. På hvert sted på prøven, hvor infrarød absorberes, materialet varmes op, får det til hurtigt, men alligevel lidt, udvide. Udvidelsen registreres, med den skarpe spids af AFM, der stikker ud fra en cantilever, som svinger som et dykkerbræt hver gang prøven udvides. Jo mere lys der absorberes af prøven, jo større dens ekspansion og jo større styrke, eller amplitude, af svingningerne.
Så god som PTIR er, at bruge metoden i et vandmiljø er problematisk. Vand absorberer kraftigt infrarødt lys, producerer et absorptionssignal, der kan forstyrre bestræbelserne på at skelne prøvens kemiske struktur. Ud over, trækkraften, der udøves af vand, er meget stærkere end i luften, og det svækker typisk PTIR -signalet, da det kraftigt dæmper svingningerne i AFM's udhæng.
For at begrænse vands absorption af infrarødt lys, holdet placerede et prisme mellem laseren og prøven. Prismet tjente til at begrænse det infrarøde lys til prøvens overflade, minimere mængden, der kan lække ud og interagere med vandet. For at løse dæmpningsproblemet, holdet brugte en laser, der kunne fungere ved frekvenser op til 2, 000 kilohertz. Det gjorde det muligt for forskerne at matche frekvensen af laserimpulserne til en af de højere frekvenser, hvor cantileveren svinger. Som at skubbe et barn på en gynge med det helt rigtige interval, frekvenstilpasningen forbedrede amplituden af cantileverens oscillationer, delvis modvirke dæmpningen på grund af vand.
For at demonstrere nøjagtigheden af deres metode, holdet sammenlignede PTIR-målinger af diphenylalanin og andre peptidprøver i to miljøer:vand og luft. (Peptiderne foldede ens i begge medier, gør det lettere at udføre sammenligningen.) Bemærkelsesværdigt, forskerne opnåede lignende rumlig opløsning og kontrast i vand og luft, demonstrerer for første gang, at målinger i et vandmiljø kan udføres præcist, afslører den præcise konformation af peptider med opløsning i nanoskala.
"Dette fund er vigtigt for biologer, der ønsker at forstå proteinstruktur og foldning i miljøer så tæt som muligt på dem i celler, " sagde Centrone.
 Varme artikler
Varme artikler
-
 Følger kemikaliernes vej gennem jordenForskere fra Aarhus Universitet har udviklet en forbedret metode til at følge transporten af kemikalier gennem jorden. Kredit:Janne Hansen Hvor bliver pesticider og deres nedbrydningsprodukter a
Følger kemikaliernes vej gennem jordenForskere fra Aarhus Universitet har udviklet en forbedret metode til at følge transporten af kemikalier gennem jorden. Kredit:Janne Hansen Hvor bliver pesticider og deres nedbrydningsprodukter a -
 Fotokemisk deracemisering af chirale forbindelser opnåetEnantiomere molekyler ligner hinanden som højre og venstre hånd. Mens begge varianter normalt opstår i kemiske reaktioner, ofte er kun en af dem effektiv inden for biologi og medicin. Hidtil, fuldst
Fotokemisk deracemisering af chirale forbindelser opnåetEnantiomere molekyler ligner hinanden som højre og venstre hånd. Mens begge varianter normalt opstår i kemiske reaktioner, ofte er kun en af dem effektiv inden for biologi og medicin. Hidtil, fuldst -
 En kunstig tunge af guld til at smage ahornsirupKredit:University of Montreal Det siges, at ahornsirup er Quebecs flydende guld. Nu har forskere ved Université de Montréal fundet en måde at bruge ægte guld – i form af nanopartikler – for hurtig
En kunstig tunge af guld til at smage ahornsirupKredit:University of Montreal Det siges, at ahornsirup er Quebecs flydende guld. Nu har forskere ved Université de Montréal fundet en måde at bruge ægte guld – i form af nanopartikler – for hurtig -
 Touchscreen-alternativ dæmper frygten for verdensmangel på indiumDet nye materiale er skabt ved hjælp af en proces kaldet plasmasputtering. Kredit:Behnam Akhavan Har du nogensinde forestillet dig din smartphone eller tablet uden en berøringsskærm? Dette kan sna
Touchscreen-alternativ dæmper frygten for verdensmangel på indiumDet nye materiale er skabt ved hjælp af en proces kaldet plasmasputtering. Kredit:Behnam Akhavan Har du nogensinde forestillet dig din smartphone eller tablet uden en berøringsskærm? Dette kan sna
- Kunstig fotosyntese kan hjælpe med at lave brændstoffer, plast og medicin
- Omgivet af lavpresterende – høj på positive følelser?
- Brug af grafenskum til at detektere subtile spor af farlige gasser, sprængstoffer
- Sådan beregnes en AHI Index
- Hvordan dopamin hjælper gøre nogle fødevarer Addicting
- Lab lukker nanorør ind i bånd ved at skyde dem mod et mål


