Hvad reduceres i 2na 2h2o ------- 2naoh H2?
* Oxidation: Tab af elektroner.
* reduktion: Gevinst af elektroner.
Lad os se på ændringerne i oxidationstilstande:
* natrium (NA): Starter som elementært natrium med en oxidationstilstand på 0. Det ender som natriumion (Na +) i NaOH, med en oxidationstilstand på +1. Dette betyder natrium * mistet * et elektron, så det blev oxideret .
* brint (H): Starter som +1 i vand (H₂O) og ender som 0 i brintgas (H₂). Dette betyder brint * opnået * et elektron, så det blev reduceret .
Derfor, mens den samlede reaktion er en redoxreaktion (både oxidation og reduktion forekommer), er det specifikke element, der reduceres, natrium.
Sidste artikelAlkali metalhydroxider og alkalisk jord er?
Næste artikelHvad er antallet af elektroner i titanium?
 Varme artikler
Varme artikler
-
 De vigtigste materialer og enheder til iboende fleksible skærmeTeknisk set er der forskellige veje til realisering af fleksibilitet. 1) Fysisk fleksibilitet:ethvert stift materiale, der er ekstremt tyndt eller har en meget lille diameter, kan være fleksibelt. 2)
De vigtigste materialer og enheder til iboende fleksible skærmeTeknisk set er der forskellige veje til realisering af fleksibilitet. 1) Fysisk fleksibilitet:ethvert stift materiale, der er ekstremt tyndt eller har en meget lille diameter, kan være fleksibelt. 2) -
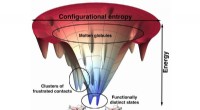 Atomopløsningsproteinmodeller afslører nye detaljer om proteinbindingAtomskalamodeller af Rice University-forskere baseret på dem, der bruges til at forudsige, hvordan proteiner folder, viser en stærk sammenhæng mellem minimalt frustrerede bindingssteder og lægemiddels
Atomopløsningsproteinmodeller afslører nye detaljer om proteinbindingAtomskalamodeller af Rice University-forskere baseret på dem, der bruges til at forudsige, hvordan proteiner folder, viser en stærk sammenhæng mellem minimalt frustrerede bindingssteder og lægemiddels -
 Beskyttelsesmembran til pacemakere forhindrer opbygning af fibrotisk vævEn cellulosemembran til beskyttelse af pacemakere. Kredit:Hylomorph En beskyttende membran til pacemakere udviklet ved ETH Zürich har vist sig vellykket i dyreforsøg med at reducere den uønskede o
Beskyttelsesmembran til pacemakere forhindrer opbygning af fibrotisk vævEn cellulosemembran til beskyttelse af pacemakere. Kredit:Hylomorph En beskyttende membran til pacemakere udviklet ved ETH Zürich har vist sig vellykket i dyreforsøg med at reducere den uønskede o -
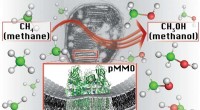 Metanforbrugende bakterier kan være fremtiden for brændstofDet primære metaboliske enzym i metanotrofe bakterier, partikelformig methanmonooxygenase (pMMO), katalyserer metan-til-methanol-omdannelsen på et sted med en kobberion. Kredit:Northwestern University
Metanforbrugende bakterier kan være fremtiden for brændstofDet primære metaboliske enzym i metanotrofe bakterier, partikelformig methanmonooxygenase (pMMO), katalyserer metan-til-methanol-omdannelsen på et sted med en kobberion. Kredit:Northwestern University
- Hvad er et eksempel på action-at-a-afstand kraft?
- Når de originale dele af en organisme i en sedimentær klippe er forvitret og eroderet, hvad udhule…
- Hvorfor er ørne afhængige af sollys for deres energi?
- Hvorfor krymper mantlen selv, og tykkelsen af skorpen stiger?
- Hvad gør fordoblingen af afstanden mellem to genstande for tyngdekraftobjekter?
- Ordre om lysstyrke mellem IO Europa Ganymede og Callisto?


