Hvorfor er natriumchlorid meget opløseligt i vand, men ikke benzin?
opløselighed og polaritet
* "som opløser som": En generel regel i kemi er, at stoffer med lignende polariteter opløses godt i hinanden.
* Polaritet: Et molekyle betragtes som polært, hvis det har en ujævn fordeling af elektrisk ladning. Den ene ende af molekylet er lidt positiv, og den anden ende er lidt negativ.
* vand (H₂O) er polær: Oxygenatomet i vand er mere elektronegativ end hydrogenatomerne, hvilket skaber en delvis negativ ladning på iltsiden og delvis positive ladninger på brintsiden.
* natriumchlorid (NaCl) er ionisk: Den stærke attraktion mellem de positivt ladede natriumioner (Na+) og negativt ladede chloridioner (Cl-) danner en krystalgitter. Når NaCl opløses, omgiver vandmolekylerne ionerne og trækker dem fra hinanden og bryder de ioniske bindinger. Denne proces kaldes hydrering .
Hvorfor NaCl ikke er opløselig i benzin
* benzin er ikke -polær: Benzin er primært sammensat af kulbrinter, som er molekyler med kulstof- og brintatomer. Disse molekyler er meget symmetriske og deler elektroner jævnt, hvilket gør dem ikke -polære.
* NaCl er ionisk og polær: Da benzin er ikke -polær, kan den ikke effektivt interagere med de ladede ioner i NaCl. Tiltrækningen mellem de ikke -polære benzinmolekyler og de ioniske NaCl -molekyler er meget svag, så NaCl opløses ikke.
Kortfattet: Vands polaritet giver det mulighed for at nedbryde de ioniske bindinger i NaCl og danne stærke attraktioner med ionerne. Benzin, der er ikke -polær, kan ikke effektivt interagere med de ladede ioner, så NaCl opløses ikke i det.
 Varme artikler
Varme artikler
-
 Hurtig og let syntese af antibakteriel aminosyre Schiff-base kobberkomplekserForskere fra Tokyo University of Science brugte en to-trins mikrobølgebestrålingsteknik til at syntetisere aminosyre Schiff base Cu (II) komplekser inden for 10 minutter. De fremstillede baser udviste
Hurtig og let syntese af antibakteriel aminosyre Schiff-base kobberkomplekserForskere fra Tokyo University of Science brugte en to-trins mikrobølgebestrålingsteknik til at syntetisere aminosyre Schiff base Cu (II) komplekser inden for 10 minutter. De fremstillede baser udviste -
 Porøse polymerfilm med formhukommelseKredit:Wiley Uanset om det er til separationsprocesser, solcelleanlæg, katalyse, eller elektronik, porøse polymermembraner er nødvendige på mange områder. Membraner med mikroporer, der skifter mel
Porøse polymerfilm med formhukommelseKredit:Wiley Uanset om det er til separationsprocesser, solcelleanlæg, katalyse, eller elektronik, porøse polymermembraner er nødvendige på mange områder. Membraner med mikroporer, der skifter mel -
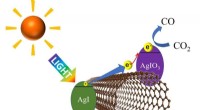 Brug af synligt lys til effektivt at nedbryde kuldioxidDen fotoeksciterede elektron fra sølviodid (AgI) bevæger sig langs kulnanorøret til sølviodat (AgIO 3 ) hvor kuldioxid (CO 2 ) reduceres til carbonmonoxid (CO). Kredit:Shinji Kawasaki og Yosuke Is
Brug af synligt lys til effektivt at nedbryde kuldioxidDen fotoeksciterede elektron fra sølviodid (AgI) bevæger sig langs kulnanorøret til sølviodat (AgIO 3 ) hvor kuldioxid (CO 2 ) reduceres til carbonmonoxid (CO). Kredit:Shinji Kawasaki og Yosuke Is -
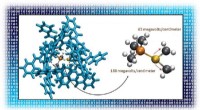 Optimering af elektriske felter giver bedre katalysatorerForstærkning af det elektriske felt i et molekyle kan gøre det til en bedre katalysator. Indpakning af en guldbaseret katalysator (venstre, center) i et større kompleks (blåt) forsyner katalysatoren m
Optimering af elektriske felter giver bedre katalysatorerForstærkning af det elektriske felt i et molekyle kan gøre det til en bedre katalysator. Indpakning af en guldbaseret katalysator (venstre, center) i et større kompleks (blåt) forsyner katalysatoren m


