Hvilket volumen ilt ved 350 -grader Celsius og et tryk 5,25ATM er nødvendigt for at konvertere 5,00 g svovltrioxid fuldstændigt?
1. Skriv den afbalancerede kemiske ligning:
Reaktionen mellem svovltrioxid (SO₃) og ilt (O₂) til dannelse af svovldioxid (SO₂) er:
2 SO₃ (G) + O₂ (G) → 2 SO₂ (G)
2. Beregn molen af So₃:
* Molmasse af SO₃ =80,06 g/mol
* Mol So₃ =(5,00 g) / (80,06 g / mol) =0,0625 mol
3. Bestem molen af O₂ krævet:
* Fra den afbalancerede ligning reagerer 2 mol SO₃ med 1 mol O₂.
* Mol O₂ Nødvendigt =(0,0625 mol SO₃) * (1 mol O₂ / 2 mol SO₃) =0,03125 mol O₂
4. Anvend den ideelle gaslov for at finde mængden af O₂:
* Ideel gaslov:PV =NRT
* P =tryk =5,25 atm
* V =lydstyrke (hvad vi vil finde)
* n =mol O₂ =0,03125 mol
* R =ideel gas konstant =0,0821 l · atm/mol · k
* T =temperatur =350 ° C + 273,15 =623,15 K
5. Løs for V:
* V =(NRT) / P
* V =(0,03125 mol * 0,0821 L · ATM / mol · K * 623,15 K) / 5,25 atm
* V ≈ 0,308 L
Derfor er der behov for ca. 0,308 liter iltgas ved 350 ° C og 5,25 atm for fuldstændigt 5,00 gram svovltrioxid.
Sidste artikelHvad er den kovalente binding for klor og klor?
Næste artikelHvad er den kemiske formel for salt?
 Varme artikler
Varme artikler
-
 Et tidligt advarselssystem for skader i kompositmaterialerDet er første gang, at data er blevet brugt på nationalt plan til at vurdere, hvordan miljøets skønhed påvirker udviklingen af vindmølleparker på land. Kredit:CC0 Public Domain Et hold ved Natio
Et tidligt advarselssystem for skader i kompositmaterialerDet er første gang, at data er blevet brugt på nationalt plan til at vurdere, hvordan miljøets skønhed påvirker udviklingen af vindmølleparker på land. Kredit:CC0 Public Domain Et hold ved Natio -
 Det nye grønne alternativ til medicinproduktionStruktur af den aktive mangankatalysator i vand. Kredit:Universitetet i Göttingen De fleste af processerne til fremstilling af lægemidler, pesticider og smartphone-skærme er omkostningstunge og ge
Det nye grønne alternativ til medicinproduktionStruktur af den aktive mangankatalysator i vand. Kredit:Universitetet i Göttingen De fleste af processerne til fremstilling af lægemidler, pesticider og smartphone-skærme er omkostningstunge og ge -
 Kemikere udvikler forskellige industrielt vigtige syntetiske processerProf. Dr. David Scheschkewitz Kredit:Saarland University/Oliver Dietze Dannelsen af dobbeltbindinger mellem to carbonatomer (C =C) er af central betydning i naturlige organismer. Langt de fleste
Kemikere udvikler forskellige industrielt vigtige syntetiske processerProf. Dr. David Scheschkewitz Kredit:Saarland University/Oliver Dietze Dannelsen af dobbeltbindinger mellem to carbonatomer (C =C) er af central betydning i naturlige organismer. Langt de fleste -
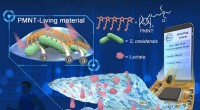 Fleksibel bioelektronisk enhed baseret på levende materiale til overvågning af laktat- og tumorcel…Skematisk diagram af PMNT-baseret levende materiale og bioelektronisk enhed til overvågning af laktat i fysiologiske væsker (sved, urin og plasma) og tælling af tumorceller. Kredit:Wang Zenghao Eft
Fleksibel bioelektronisk enhed baseret på levende materiale til overvågning af laktat- og tumorcel…Skematisk diagram af PMNT-baseret levende materiale og bioelektronisk enhed til overvågning af laktat i fysiologiske væsker (sved, urin og plasma) og tælling af tumorceller. Kredit:Wang Zenghao Eft
- Hvordan og hvornår blev kulstof fordelt på jorden?
- Cliff erosion ved Barton på havet?
- Fakta om prokaryotisk
- Kunstigt DNA kan kontrollere frigivelsen af aktive ingredienser fra lægemidler
- Hvorfor holder et alkalisk batteri længere end et surt tørbatteri?
- Hvordan adskiller densiteten af oceanisk skorpe sig fra den kontinentale skorpe?


