Hvad er den kovalente binding for klor og klor?
* Chlorens valenselektroner: Chlor har 7 valenselektroner (elektroner i dets yderste skal). For at opnå en stabil octet (8 elektroner) har den brug for endnu en elektron.
* Deling af elektroner: Når to kloratomer binder sig, deler de hver en af deres valenselektroner. Dette skaber et delt par elektroner, som begge kloratomer tæller som en del af deres oktet.
* ikke -polær kovalent binding: De delte elektroner tiltrækkes ligeligt til begge chloratomer, hvilket resulterer i en ikke -polær kovalent binding.
Her er en forenklet repræsentation:
* CL + CL → CL-CL
Dette delte par elektroner skaber en stabil binding mellem de to kloratomer, der danner et klormolekyle (CL 2 ).
 Varme artikler
Varme artikler
-
 Nyt værktøj kan hjælpe forskere med at identificere enzymer i mikrobiomerKredit:Kris Snibbe/Harvard University For forskere, der studerer de mulige forbindelser mellem menneskers sundhed og de billioner af mikrober, der bebor vores fordøjelseskanal, det, der gør arbejd
Nyt værktøj kan hjælpe forskere med at identificere enzymer i mikrobiomerKredit:Kris Snibbe/Harvard University For forskere, der studerer de mulige forbindelser mellem menneskers sundhed og de billioner af mikrober, der bebor vores fordøjelseskanal, det, der gør arbejd -
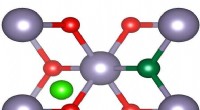 Discovery peger på vejen til bedre og billigere transparente ledereKompensation af acceptor fluorinterstitialer (lysegrøn) reducerer dramatisk elektronisk ydeevne af tindioxid gennemsigtige ledende glasbelægninger dopet med fluoratomer (mørkegrønne). Kredit:Universit
Discovery peger på vejen til bedre og billigere transparente ledereKompensation af acceptor fluorinterstitialer (lysegrøn) reducerer dramatisk elektronisk ydeevne af tindioxid gennemsigtige ledende glasbelægninger dopet med fluoratomer (mørkegrønne). Kredit:Universit -
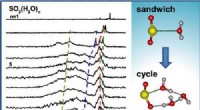 Forskere afslører trinvise hydreringsmotiver af svovldioxidGrafisk abstrakt. Kredit:The Journal of Physical Chemistry Letters (2022). DOI:10.1021/acs.jpclett.2c01472 Et forskerhold ledet af prof. Jiang Ling og Zhang Zhaojun fra Dalian Institute of Chemical
Forskere afslører trinvise hydreringsmotiver af svovldioxidGrafisk abstrakt. Kredit:The Journal of Physical Chemistry Letters (2022). DOI:10.1021/acs.jpclett.2c01472 Et forskerhold ledet af prof. Jiang Ling og Zhang Zhaojun fra Dalian Institute of Chemical -
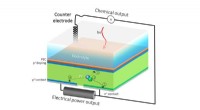 En solcelle, der gør dobbelt pligt til vedvarende energiHPEV -cellens ekstra stikkontakt gør det muligt at opdele strømmen i to, så en del af strømmen bidrager til produktion af solbrændstoffer, og resten kan udvindes som elektrisk strøm. Kredit:Berkeley L
En solcelle, der gør dobbelt pligt til vedvarende energiHPEV -cellens ekstra stikkontakt gør det muligt at opdele strømmen i to, så en del af strømmen bidrager til produktion af solbrændstoffer, og resten kan udvindes som elektrisk strøm. Kredit:Berkeley L


