Har kobberoxid ioniske bindinger?
* Elektronegativitetsforskel: Kobber (Cu) er et metal med en relativt lav elektronegativitet, mens ilt (O) er en ikke -metal med en høj elektronegativitet. Forskellen i elektronegativitet mellem kobber og ilt er betydelig, hvilket fører til en overførsel af elektroner.
* Elektronoverførsel: Oxygen har en stærk attraktion for elektroner, så den trækker elektroner væk fra kobber. Dette resulterer i, at kobbertabning af elektroner og bliver en positivt ladet kation (Cu²⁺), mens ilt får elektroner og bliver en negativt ladet anion (O²⁻).
* Elektrostatisk attraktion: De modsatte ladede ioner tiltrækker hinanden gennem elektrostatiske kræfter og danner en ionisk binding.
Derfor udgør den stærke elektrostatiske tiltrækning mellem de positivt ladede kobberioner og de negativt ladede iltioner i kobberoxid en ionisk binding.
 Varme artikler
Varme artikler
-
 Kemiske ingeniører fremmer produktionen af olefiner gennem beregningsmodelleringIllustration fra forsiden af ACS katalyse viser et vulkan aktivitetsplot, svarende til den, der er konstrueret i beregninger for at screene aktiviteten af forskellige steder på metaloxider, med to
Kemiske ingeniører fremmer produktionen af olefiner gennem beregningsmodelleringIllustration fra forsiden af ACS katalyse viser et vulkan aktivitetsplot, svarende til den, der er konstrueret i beregninger for at screene aktiviteten af forskellige steder på metaloxider, med to -
 Strategisk formulering af almindelig cement kan have stor indflydelse på vandrensningÅbne kanaler, der fører vand, kan laves med en ny cementformulering, der vil rense vandet via soleksponering, når det strømmer mod sin destination. Kredit:U.S. Geological Survey Department of the Inte
Strategisk formulering af almindelig cement kan have stor indflydelse på vandrensningÅbne kanaler, der fører vand, kan laves med en ny cementformulering, der vil rense vandet via soleksponering, når det strømmer mod sin destination. Kredit:U.S. Geological Survey Department of the Inte -
 Kemikere syntetiserer psykotrope forbindelser fra regnskovstræKredit:Scripps Research Institute Barken fra Galbulimima belgraveana-træet, der kun findes i fjerntliggende regnskove i Papua Ny Guinea og det nordlige Australien, har længe været brugt af oprindel
Kemikere syntetiserer psykotrope forbindelser fra regnskovstræKredit:Scripps Research Institute Barken fra Galbulimima belgraveana-træet, der kun findes i fjerntliggende regnskove i Papua Ny Guinea og det nordlige Australien, har længe været brugt af oprindel -
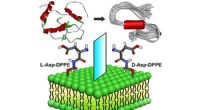 Nye fund kaster lys over udviklingen af liposom-baserede hæmmereMolekylær chiralitet medieret amyloiddannelse på phospholipidoverflader. Kredit:WANG Xue Alzheimers sygdom (AD) er en af de største globale folkesundhedsudfordringer. Imidlertid, patogenesen af
Nye fund kaster lys over udviklingen af liposom-baserede hæmmereMolekylær chiralitet medieret amyloiddannelse på phospholipidoverflader. Kredit:WANG Xue Alzheimers sygdom (AD) er en af de største globale folkesundhedsudfordringer. Imidlertid, patogenesen af
- Hvad hjerneædende amøber kan fortælle os om mangfoldigheden af liv på jorden og evolutionær h…
- Sådan fungerer Radar
- NASA får en natvisning, ex-Tropical Cyclone Dineo
- Et projektil er blevet fyret vandret fra toppen af en bygning 40 m høj forsømmende luftmodstand …
- Et teleskops lyssamling øges, når målet øges?
- Hvad ville der ske, hvis turbiner brugte al energien i vand?


