Nye fund kaster lys over udviklingen af liposom-baserede hæmmere
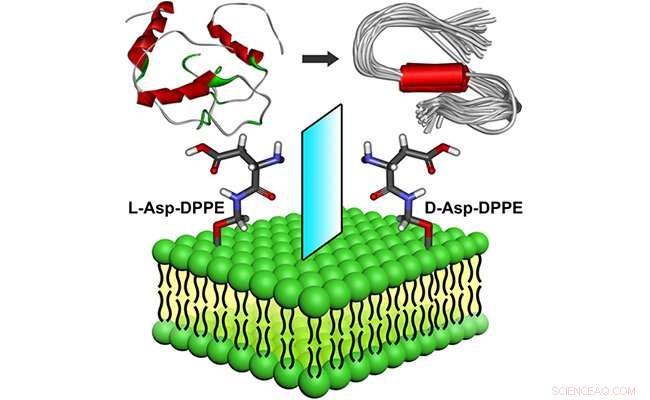
Molekylær chiralitet medieret amyloiddannelse på phospholipidoverflader. Kredit:WANG Xue
Alzheimers sygdom (AD) er en af de største globale folkesundhedsudfordringer. Imidlertid, patogenesen af AD er stadig uklar.
En række undersøgelser viste, at cellemembraner spiller en afgørende rolle i udviklingen af AD, især amyloid-β (Aβ) akkumulering. Derfor er det vigtigt at undersøge virkningen af biologiske membraner på amyloiddannelse.
For nylig, forskningsgrupper ledet af prof. Qing Guangyan og prof. Li Guohui fra Dalian Institute of Chemical Physics ved det kinesiske videnskabsakademi designet og forberedte et par chirale aminosyremodificerede fosfolipider, viser bemærkelsesværdig indflydelse af molekylær chiralitet af chirale liposomer på amyloiddannelse.
Forskerne fandt ud af, at de selvsamlede L-liposomer lidt hæmmede Aβ(1-40)-kernedannelsesprocessen, men kunne ikke påvirke oligomerforlængelsesprocessen. Til sammenligning, D-liposomerne hæmmede stærkt både nukleations- og forlængelsesprocesserne af Aβ(1-40).
Chirale liposomer havde ikke kun god biokompatibilitet, men kunne også redde Aβ(1-40) aggregeringsinduceret cytotoksicitet med betydelig chiral skelnen, hvor cellelevedygtigheden var højere i nærvær af D-liposomer.
I mellemtiden forskerne afslørede bindingsstedet, bindingsmåder og drivkraft mellem Aβ(1-40) og chirale fosfolipidoverflader gennem detaljerede simuleringer af molekylær dynamik.
Disse resultater udvidede forskningen fra kunstige chirale overflader til ægte chirale fosfolipidoverflader, at give en dybere og reel indsigt i at forstå den afgørende amyloidoseproces fra perspektivet af chiral biointerface.
Liposomer har overbevisende biokompatibilitet, og konvergensen af liposomer med ikke-naturlige D-aminosyrer som amyloidhæmmere er lovende i tidlig forebyggelse og behandling af AD, som peger på en klar retning for udviklingen af liposom-baserede hæmmere.
Undersøgelsen blev offentliggjort i Kemisk Videnskab den 25. juni.
 Varme artikler
Varme artikler
-
 Meget effektiv ammoniaksyntesekatalysator udvikletSammenligning af ammoniaksynteseaktivitet (reaktionstemperatur 260ºC, tryk 9 atm). Kredit: Angewandte Chemie Forskere ved Tokyo Institute of Technology (Tokyo Tech) har opdaget, at en katalysator
Meget effektiv ammoniaksyntesekatalysator udvikletSammenligning af ammoniaksynteseaktivitet (reaktionstemperatur 260ºC, tryk 9 atm). Kredit: Angewandte Chemie Forskere ved Tokyo Institute of Technology (Tokyo Tech) har opdaget, at en katalysator -
 Mere effektive fotokatalysatorer kunne frigøre solenergiens potentiale(l-r) Jan Kosco, Iain McCulloch og Calvyn Howells diskuterer potentialet i deres brintudviklingsfotokatalysator. Kredit:KAUST En organisk halvlederfotokatalysator, der markant forbedrer generering
Mere effektive fotokatalysatorer kunne frigøre solenergiens potentiale(l-r) Jan Kosco, Iain McCulloch og Calvyn Howells diskuterer potentialet i deres brintudviklingsfotokatalysator. Kredit:KAUST En organisk halvlederfotokatalysator, der markant forbedrer generering -
 Forskere opdager kroppens beskyttelsesskjoldBillede af et fluesår og betændelse. Kredit:Helen Weavers Forskere har opdaget en måde at manipulere kroppens eget immunrespons for at øge vævsreparation. Fundene, udgivet i Aktuel biologi i dag
Forskere opdager kroppens beskyttelsesskjoldBillede af et fluesår og betændelse. Kredit:Helen Weavers Forskere har opdaget en måde at manipulere kroppens eget immunrespons for at øge vævsreparation. Fundene, udgivet i Aktuel biologi i dag -
 Selv efter håndvask, ny fngerprint test kan skelne mellem dem, der har taget eller håndteret heroi…Kredit:CC0 Public Domain En avanceret fingeraftryksdetektionsteknologi kan identificere spor af heroin på menneskelig hud, selv efter at nogen har vasket deres hænder – og det er også smart nok at
Selv efter håndvask, ny fngerprint test kan skelne mellem dem, der har taget eller håndteret heroi…Kredit:CC0 Public Domain En avanceret fingeraftryksdetektionsteknologi kan identificere spor af heroin på menneskelig hud, selv efter at nogen har vasket deres hænder – og det er også smart nok at
- Langt væk, så tæt på
- Kulstoffattig energiovergang kræver mere vedvarende energi end tidligere antaget
- 51 % af amerikanerne er enige om, at betalende college-atleter bør tillades
- Exoplanet HD 131399 Ab viser sig at være en baggrundsstjerne, ny undersøgelse finder
- Forskere studerer, hvordan vejrnyheder påvirker passagerer med offentlig transport
- Bevis for topkvarker ved kollisioner mellem tunge kerner


