Kan ilt frigøres fra alle indeholdende forbindelser?
* obligationsstyrke: Styrken af den kemiske binding mellem ilt og andre elementer varierer meget. Nogle obligationer er meget stærke og kræver meget energi for at bryde, hvilket gør iltfrigørelsen vanskelig eller umulig.
* stabilitet af forbindelsen: Nogle forbindelser er meget stabile og nedbrydes ikke let for at frigive ilt. For eksempel er vand (H₂O) ret stabilt og frigiver ikke let ilt under normale forhold.
* reaktionsbetingelser: Befrielsen af ilt kræver ofte specifikke reaktionsbetingelser, såsom høj temperatur, tilstedeværelsen af en katalysator eller elektrolyse.
Eksempler på forbindelser, hvor iltfrigørelse er mulig:
* Oxider: Mange metaloxider, som Mercuricoxid (HGO), kan nedbrydes af varme for at frigive ilt.
* peroxider: Forbindelser indeholdende peroxidgruppen (-O-O-) som hydrogenperoxid (H₂O₂) nedbrydes let for at frigive ilt.
* chlorater: Forbindelser, der indeholder chloratgruppen (-clo₃) som kaliumchlorat (KCLO₃), nedbrydes, når de opvarmes for at frigive ilt.
Eksempler på forbindelser, hvor iltfrigørelse er vanskelig eller umulig:
* vand (H₂O)
* kuldioxid (co₂)
* silicater (sio₂)
Kortfattet: Mens ilt kan frigøres fra visse forbindelser under specifikke forhold, er det ikke muligt at befri ilt fra alle iltholdige forbindelser.
Sidste artikelHvordan kan du se, om en gas er brint?
Næste artikelHvilke forbindelser dannes, når en syre reagerer med oxid?
 Varme artikler
Varme artikler
-
 Samspillet mellem kemiske spejlbillederChristian Merten arbejder på Bochum Institut for Organisk Kemi II og er medlem af Cluster of Excellence Resolv. Kredit:RUB, Kramer Kemikere fra Ruhr-Universität Bochum håber at finde ud af, hvor s
Samspillet mellem kemiske spejlbillederChristian Merten arbejder på Bochum Institut for Organisk Kemi II og er medlem af Cluster of Excellence Resolv. Kredit:RUB, Kramer Kemikere fra Ruhr-Universität Bochum håber at finde ud af, hvor s -
 Maskinlæring forudsiger mekaniske egenskaber af porøse materialerKrystallinsk metal-organisk ramme. Kredit:David Fairen-Jimenez Maskinlæring kan bruges til at forudsige egenskaberne af en gruppe materialer, som, ifølge nogle, kunne være lige så vigtig for det 2
Maskinlæring forudsiger mekaniske egenskaber af porøse materialerKrystallinsk metal-organisk ramme. Kredit:David Fairen-Jimenez Maskinlæring kan bruges til at forudsige egenskaberne af en gruppe materialer, som, ifølge nogle, kunne være lige så vigtig for det 2 -
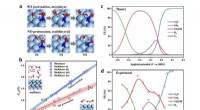 Forskere afslører potentiel afhængighed af nitrogenoxid -elektrisk reduktion til ammoniak(a)-(b) Verifikation af monolagsvandmodel i elektrokatalytiske energibarriereberegninger; (c)-(d) Sammenligning af teoretisk og eksperimentel faradaisk effektivitet. Kredit:LONG Jun Kvælstofoxid (
Forskere afslører potentiel afhængighed af nitrogenoxid -elektrisk reduktion til ammoniak(a)-(b) Verifikation af monolagsvandmodel i elektrokatalytiske energibarriereberegninger; (c)-(d) Sammenligning af teoretisk og eksperimentel faradaisk effektivitet. Kredit:LONG Jun Kvælstofoxid ( -
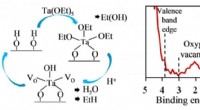 Ikke -flygtig hukommelse så hurtigt som RAM med flash -kapacitetStadier af kemiske reaktioner involveret i aflejringen af iltmangel tantaloxidfilm (til venstre) og resultaterne af deres analyse ved hjælp af røntgenfotoelektronspektroskopi (højre) Kredit:MIPTs Pr
Ikke -flygtig hukommelse så hurtigt som RAM med flash -kapacitetStadier af kemiske reaktioner involveret i aflejringen af iltmangel tantaloxidfilm (til venstre) og resultaterne af deres analyse ved hjælp af røntgenfotoelektronspektroskopi (højre) Kredit:MIPTs Pr
- Kan specifikke typer celler være en del af flere forskellige organer?
- Klimamodel forudsiger flere kraftige nedbørshændelser over aktive vulkaner, efterhånden som plane…
- Kosmiske blink kommer i alle forskellige størrelser
- Banebrydende forskning for at revolutionere internetkommunikation
- Ny ventilteknologi lover billigere, grønnere motorer
- Afsløring af mekanismerne bag forbedringen af grafiske nanofluiders termiske egenskaber


