Flydende brom rystes med en natriumiodidopløsning?
Her er en sammenbrud af reaktionen:
reaktion:
Br₂ (L) + 2NAi (aq) → I₂ (aq) + 2nabr (aq)
Forklaring:
* brom (br₂) er et stærkere oxidationsmiddel end jod (i₂). Dette betyder, at brom er mere tilbøjelig til at vinde elektroner og blive reduceret.
* iodidioner (i⁻) oxideres af brom. De mister elektroner og bliver iodmolekyler (I₂).
* brom bliver reduceret Ved at vinde elektroner fra iodidioner og bliver bromidioner (BR⁻).
* natriumioner (NA⁺) forbliver uændret som tilskuerioner.
Observationer:
* Løsningen bliver brun/rød. Dette skyldes dannelsen af jod, der er brun/rød i farve.
* Reaktionen er eksoterm , hvilket betyder, at det frigiver varme.
Bemærk: Denne reaktion er et klassisk eksempel på en halogenfortrængningsreaktion, hvor en mere reaktiv halogen fortrænger en mindre reaktiv halogen fra dens saltopløsning.
Sidste artikelHvad er surhedsgraden af brintchlorid?
Næste artikelHvad er et ukendt element som en farveløs gas ved stuetemperatur?
 Varme artikler
Varme artikler
-
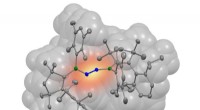 Nydesignet molekyle binder nitrogenEt nitrogenmolekyle (blåt) har bundet sig til to borylenmolekyler (grå). Boratomerne involveret i bindingen er farvet grønne i illustrationen. Kredit:Dr. Rian Dewhurst, JMU Hvede, hirse og majs ha
Nydesignet molekyle binder nitrogenEt nitrogenmolekyle (blåt) har bundet sig til to borylenmolekyler (grå). Boratomerne involveret i bindingen er farvet grønne i illustrationen. Kredit:Dr. Rian Dewhurst, JMU Hvede, hirse og majs ha -
 Mikroenhed kunne opfange tidlige tegn på hjerteanfald eller slagtilfældeKredit:University of Sydney I Australien lider hvert år cirka 55.000 mennesker af et hjerteanfald, hvoraf et tilsvarende antal lider af slagtilfælde. Mange er forårsaget af blodpropper, der blokere
Mikroenhed kunne opfange tidlige tegn på hjerteanfald eller slagtilfældeKredit:University of Sydney I Australien lider hvert år cirka 55.000 mennesker af et hjerteanfald, hvoraf et tilsvarende antal lider af slagtilfælde. Mange er forårsaget af blodpropper, der blokere -
 Forudsige året i kemiKredit:CC0 Public Domain Med 2020 lige begyndt, forskere rundt om i verden undrer sig over, hvad året har i vente for dem. For at hjælpe med at styre dem lige, Kemi- og ingeniørnyheder ( C&EN
Forudsige året i kemiKredit:CC0 Public Domain Med 2020 lige begyndt, forskere rundt om i verden undrer sig over, hvad året har i vente for dem. For at hjælpe med at styre dem lige, Kemi- og ingeniørnyheder ( C&EN -
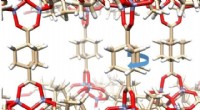 Gyroskopmolekyler danner krystal, der er både fast og fuld af bevægelseUCLA -forskere dannede en krystal ud af molekyler, der hver har et solidt ydre, men indeholder bevægelige dele. Kredit:Kendall Houk Laboratory/UCLA Molekylære maskiner, meget mindre end enkeltcell
Gyroskopmolekyler danner krystal, der er både fast og fuld af bevægelseUCLA -forskere dannede en krystal ud af molekyler, der hver har et solidt ydre, men indeholder bevægelige dele. Kredit:Kendall Houk Laboratory/UCLA Molekylære maskiner, meget mindre end enkeltcell
- Potentiel kønsbias mod kvindelige forskere i peer review af forskningsbevillinger
- Undersøgelse detaljer, hvordan biomimetiske nanomaterialer kan minimere skader efter et hjerteanfal…
- Fysikere afslørede spontan T-symmetribrud og usædvanlige punkter i hulrum QED
- Hvad er forskellen mellem konkave og konvekse spejle?
- Består syretesten:Nyt lav-pH-system genbruger mere kulstof til værdifulde produkter
- En tidskapsel indeholdende 118 billioner kubikfod gas er begravet i det nordlige Australien


