Hvorfor har ammoniumioner positiv ladning?
* nitrogens rolle: Nitrogen har fem valenselektroner (elektroner i dets yderste skal). Den ønsker at have otte elektroner for at opnå en stabil konfiguration som de ædle gasser.
* Hydrogen's rolle: Hvert hydrogenatom har en valenselektron.
* Deling af elektroner: I ammoniumionen deler nitrogenatomet sine fem valenselektroner med fire hydrogenatomer. Dette danner fire kovalente bindinger, hvor hver binding involverer to delte elektroner.
* ujævn deling: Imidlertid har nitrogenatomet også et ensomt par elektroner (to elektroner, der ikke er involveret i binding). Disse elektroner tiltrækkes stærkere til nitrogenkernen end til brintkernerne. Dette skaber en lidt positiv ladning på hvert hydrogenatom og en lidt negativ ladning på nitrogenatomet.
* samlet afgift: På grund af den ujævne deling af elektroner holder nitrogenatomet effektivt "på" flere elektroner, end det bidrager. Dette skaber en nettopositiv ladning på hele ammoniumionen (+1).
Kortfattet: Ammoniumionen har en positiv ladning, fordi nitrogenatomet tiltrækker elektroner stærkere end hydrogenatomerne, hvilket resulterer i en nettopositiv ladning på ion.
Sidste artikelHvad hedder Compound FEF3 9H2O?
Næste artikelHvor mange gram vand dannes til 1 mol propanale forbrændinger?
 Varme artikler
Varme artikler
-
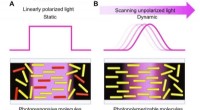 Fotopolymerisationsudløst molekylær bevægelse til fleksibelt flydende krystaldisplayA repræsenterer den molekylære justering gennem konventionelle fotojusteringsmetoder. B repræsenterer den molekylære justering opnået gennem den aktuelt rapporterede scanningsbølgefotopolymeriseringsm
Fotopolymerisationsudløst molekylær bevægelse til fleksibelt flydende krystaldisplayA repræsenterer den molekylære justering gennem konventionelle fotojusteringsmetoder. B repræsenterer den molekylære justering opnået gennem den aktuelt rapporterede scanningsbølgefotopolymeriseringsm -
 Undersøgelse baner vejen for oprettelse af tænd- og slukknapper til kemiske reaktionerVed at arbejde under ekstremt kontrollerede forhold, Eric Hudson og hans kolleger kunne observere egenskaber ved atomer og molekyler, der tidligere har været skjult for øje. Kredit:Stuart Wolpert/UCLA
Undersøgelse baner vejen for oprettelse af tænd- og slukknapper til kemiske reaktionerVed at arbejde under ekstremt kontrollerede forhold, Eric Hudson og hans kolleger kunne observere egenskaber ved atomer og molekyler, der tidligere har været skjult for øje. Kredit:Stuart Wolpert/UCLA -
 Team udvikler hurtig autentificeringsmetode for kinesisk medicinPolyUs forskerhold ledet af Dr Yao Zhongping, lektor ved Institut for Anvendt Biologi og Kemisk Teknologi, har udviklet en ny metode til hurtig autentificering af kinesisk urtemedicin, inklusive Lingz
Team udvikler hurtig autentificeringsmetode for kinesisk medicinPolyUs forskerhold ledet af Dr Yao Zhongping, lektor ved Institut for Anvendt Biologi og Kemisk Teknologi, har udviklet en ny metode til hurtig autentificering af kinesisk urtemedicin, inklusive Lingz -
 Forskere bruger forskydningskræfter til at skabe selvsamlet supramolekylær hydrogelKemiske strukturer og overblik over geleringsprocessen. Kredit: Naturkemi (2019). DOI:10.1038/s41557-019-0235-8 Et team af forskere ved Southern University of Science and Technology i Kina har fu
Forskere bruger forskydningskræfter til at skabe selvsamlet supramolekylær hydrogelKemiske strukturer og overblik over geleringsprocessen. Kredit: Naturkemi (2019). DOI:10.1038/s41557-019-0235-8 Et team af forskere ved Southern University of Science and Technology i Kina har fu
- Hvad sker der med tætheden af et stof, hvis du ændrer beløb eller former det stof?
- Hvad var det største forslag i Charles om art af arter?
- Hvad er computere i vejrprognoser i vejrtrækning med henvisning til rumteknologi?
- Trump træder ind i sikkerhedsboble; vil han tage sin telefon med?
- Hvordan ligner chlor-37 og calcium-40 hinanden?
- Effektiviteten af naturinspireret metaheuristik i dyr global optimering med begrænset budget


