Hvor mange gram vand dannes til 1 mol propanale forbrændinger?
1. Skriv den afbalancerede kemiske ligning:
Forbrændingen af propanal (C₃H₆O) producerer kuldioxid (CO₂) og vand (H₂O):
C₃H₆O + 4O₂ → 3CO₂ + 3H₂O
2. Bestem molforholdet mellem vand og propanal:
Fra den afbalancerede ligning ser vi, at 1 mol propanal (C₃H₆O) producerer 3 mol vand (H₂O).
3. Konverter mol vand til gram:
* Den molære vandmasse (H₂O) er 18,015 g/mol.
* Brug af molforholdet og den molære vandmasse:
3 mol H₂O × 18,015 g/mol =54,045 g H₂O
Derfor dannes 54.045 gram vand, når 1 mol propanale forbrændinger.
Sidste artikelHvorfor har ammoniumioner positiv ladning?
Næste artikelHvad er holdbarheden af jernchlorid?
 Varme artikler
Varme artikler
-
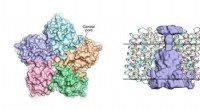 Forskere afslører strukturen af virale rhodopsinerTil venstre:et billede af OLPVRII -pentameren fra den cytoplasmatiske side. Den centrale pore er kontureret af en rød cirkel. Til højre:set fra siden af pentameren. Den centrale pore er farvet lyseb
Forskere afslører strukturen af virale rhodopsinerTil venstre:et billede af OLPVRII -pentameren fra den cytoplasmatiske side. Den centrale pore er kontureret af en rød cirkel. Til højre:set fra siden af pentameren. Den centrale pore er farvet lyseb -
 Metalåndende bakterier kan transformere elektronik, biosensorer, og mereKredit:Rensselaer Polytekniske Institut Når Shewanella oneidensis-bakterien ånder i visse metal- og svovlforbindelser anaerobt, hvordan en aerob organisme behandler ilt, det producerer materialer,
Metalåndende bakterier kan transformere elektronik, biosensorer, og mereKredit:Rensselaer Polytekniske Institut Når Shewanella oneidensis-bakterien ånder i visse metal- og svovlforbindelser anaerobt, hvordan en aerob organisme behandler ilt, det producerer materialer, -
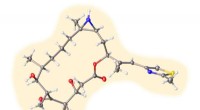 Lab skaber hårde, men øm, kræftkæmpereStruktur af en af analogerne til epothilon B, en ny forbindelse oprettet i Rice University lab af syntetisk organisk kemiker K.C. Nicolaou, der viser løfte som kræftkæmper. Kredit:Nicolaou Group/Ric
Lab skaber hårde, men øm, kræftkæmpereStruktur af en af analogerne til epothilon B, en ny forbindelse oprettet i Rice University lab af syntetisk organisk kemiker K.C. Nicolaou, der viser løfte som kræftkæmper. Kredit:Nicolaou Group/Ric -
 Forbedret metode til fremstilling af forgrenede polymererGrafisk abstrakt. Kredit:Chem (2022). DOI:10.1016/j.chempr.2022.02.022 Forgrenede polymerer, polymerer, der ligner små trægrene, har et betydeligt potentiale for vandfiltrering, det biomedicinske o
Forbedret metode til fremstilling af forgrenede polymererGrafisk abstrakt. Kredit:Chem (2022). DOI:10.1016/j.chempr.2022.02.022 Forgrenede polymerer, polymerer, der ligner små trægrene, har et betydeligt potentiale for vandfiltrering, det biomedicinske o
- Hvorfor er der ikke noget liv på stjerner?
- Hvad hedder stjernerne, som du kan se hele natten?
- Hvad er smeltepunktet for element roentgenium?
- Hvad sker der med temperaturen i hovedsekvensstjerner, når lysstyrken øges?
- Hvornår går solen ned 23,5 grader lavere end Celestial ækvator?
- Ice Age søkøer kan have kaldt Texas hjem


