Kan kalium og svovl kan danne en ionisk forbindelse?
* kalium (k) er et metal, og metaller har en tendens til at miste elektroner til dannelse af positivt ladede ioner (kationer). Kalium har en valenselektron og mister den let til dannelse af k⁺.
* svovl (r) er en ikke -metal, og ikke -metaller har en tendens til at få elektroner til at danne negativt ladede ioner (anioner). Svovl har seks valenselektroner og har brug for to mere for at afslutte sin oktet. Det får to elektroner til at danne s²⁻.
Når kalium og svovl reagerer, donerer kaliumatomer deres elektroner til svovlatomer og danner en ionisk binding. Den resulterende forbindelse er kaliumsulfid (K₂s) .
Formel K₂S repræsenterer følgende:
* To kaliumioner (k⁺) for hver sulfidion (s²⁻) for at afbalancere ladningerne.
* Den samlede ladning af forbindelsen er neutral.
Nøglepunkter:
* Ioniske forbindelser dannes mellem metaller og ikke -metaller.
* Den elektrostatiske tiltrækning mellem modsat ladede ioner holder forbindelsen sammen.
* Den kemiske formel for en ionisk forbindelse afspejler forholdet mellem kationer og anioner, der er nødvendige for at opnå neutralitet.
Sidste artikelVed O -grader er Celsius eller 273K nitrogen en fast gas?
Næste artikelHvad er nogle af de kemiske reaktioner brint?
 Varme artikler
Varme artikler
-
 Potentialet ved fleksible OLED'er som et innovativt overfladematerialeKredit:Vashchig, Shutterstock Beklædning med høj synlighed er et vigtigt element i enhver motorcyklists sikkerhedsrutine. Sådanne produkter indeholder normalt reflekterende strimler for øget synli
Potentialet ved fleksible OLED'er som et innovativt overfladematerialeKredit:Vashchig, Shutterstock Beklædning med høj synlighed er et vigtigt element i enhver motorcyklists sikkerhedsrutine. Sådanne produkter indeholder normalt reflekterende strimler for øget synli -
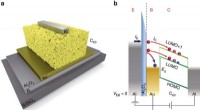 Marcus regime i organiske enheder - grænsefladeladningsoverførselsmekanisme verificeretEnhedsskemaer. a – Skematisk tværsnit af enheden. b – Varmelektrontransistordrift. Elektroner injiceres ved at anvende en negativ emitter-base bias, og detekteret i den molekylære halvleder. Disse ele
Marcus regime i organiske enheder - grænsefladeladningsoverførselsmekanisme verificeretEnhedsskemaer. a – Skematisk tværsnit af enheden. b – Varmelektrontransistordrift. Elektroner injiceres ved at anvende en negativ emitter-base bias, og detekteret i den molekylære halvleder. Disse ele -
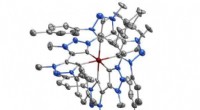 Moderne alkymi skaber selvlysende jernmolekylerKredit:Lunds Universitet En gruppe forskere ved Lunds Universitet i Sverige har lavet det første jernbaserede molekyle, der er i stand til at udsende lys. Dette kunne bidrage til udviklingen af
Moderne alkymi skaber selvlysende jernmolekylerKredit:Lunds Universitet En gruppe forskere ved Lunds Universitet i Sverige har lavet det første jernbaserede molekyle, der er i stand til at udsende lys. Dette kunne bidrage til udviklingen af -
 Unik molekylær KODE:Paramagnetisk kodning af molekylerForskerne brugte et sæt molekyler indeholdende to forskellige lanthanider til at kode billedet af ordet CODE, som de derefter læste ved hjælp af magnetisk resonans (kunstnerisk gengivelse). Kredit:Tom
Unik molekylær KODE:Paramagnetisk kodning af molekylerForskerne brugte et sæt molekyler indeholdende to forskellige lanthanider til at kode billedet af ordet CODE, som de derefter læste ved hjælp af magnetisk resonans (kunstnerisk gengivelse). Kredit:Tom
- Det periodiske system opdaget ved St. Andrews anerkendt som ældste i verden
- Hvor kommer den varme, der varmer endotermiske dyr, fra?
- Kemikere skaber et molekyle, der kan hjælpe med at behandle hjertesygdomme og opdage vira
- Er amlaen syre eller base?
- Hvem opfandt kernen?
- Hvordan opnår atomer stabil konfiguration af ædelgas?


