Hvad er nogle af de kemiske reaktioner brint?
forbrænding:
* reaktion med ilt: Den mest almindelige reaktion af brint er med ilt til dannelse af vand:
* 2 h₂ (g) + O₂ (g) → 2 H₂O (L) Denne reaktion frigiver en betydelig mængde energi og er grundlaget for brintbrændselsceller.
reaktioner med ikke-metaler:
* reaktion med halogener (f₂, cl₂, br₂, i₂): Hydrogen reagerer med halogener for at danne brinthalogenider:
* H₂ (g) + x₂ (g) → 2 Hx (g) (hvor X er en halogen)
* reaktion med nitrogen: Ved høje temperaturer og tryk reagerer brint med nitrogen for at danne ammoniak:
* n₂ (g) + 3 h₂ (g) → 2 nh₃ (g) Dette er Haber-Bosch-processen, en afgørende industriel proces til gødningsproduktion.
* reaktion med svovl: Hydrogen reagerer med svovl for at danne hydrogensulfid, en ondskabsfuld gas:
* H₂ (G) + S (S) → H₂s (G)
reaktioner med metaller:
* Dannelse af hydrider: Hydrogen reagerer med visse metaller (alkali og alkaliske jordmetaller) for at danne ioniske hydrider:
* 2 m (s) + H₂ (g) → 2 mh (s) (hvor m er en alkali eller alkalisk jordmetal)
reaktioner i organisk kemi:
* Hydrogenering: Hydrogen bruges til at tilsætte hydrogenatomer til umættede organiske molekyler, der konverterer alkener til alkaner:
* C =C + H₂ → C-C
* Reduktionsreaktioner: Hydrogen er et almindeligt reduktionsmiddel, der bruges til at reducere en række organiske forbindelser.
Andre vigtige reaktioner:
* Produktion af brint: Brint kan produceres ved hjælp af flere metoder, herunder:
* dampreformering af metan: CH₄ + H₂O → CO + 3H₂
* Elektrolyse af vand: 2 H₂O → 2 H₂ + O₂
* nuklear fusion: Hydrogenisotoper (deuterium og tritium) kan gennemgå atomfusion for at frigive enorme mængder energi:
* ²h + ³h → ⁴he + n + energi
Dette er kun en lille prøve af de mange kemiske reaktioner, der involverer brint. Alsidigheden af brint og dets evne til at deltage i reaktioner med forskellige elementer og forbindelser gør det til et vigtigt element i forskellige videnskabelige og industrielle anvendelser.
Sidste artikelKan kalium og svovl kan danne en ionisk forbindelse?
Næste artikelHvordan finder du et elektron i neutralt atom?
 Varme artikler
Varme artikler
-
 Mekaniske egenskaber af viralt DNA bestemmer infektionsforløbetVira kan injicere deres DNA i en værtscelle synkront eller tilfældigt, finder en ny undersøgelse. Forskellen ser ud til at påvirke infektionsforløbet. Kredit:Alex Evilevitch og Ting Liu En ny unde
Mekaniske egenskaber af viralt DNA bestemmer infektionsforløbetVira kan injicere deres DNA i en værtscelle synkront eller tilfældigt, finder en ny undersøgelse. Forskellen ser ud til at påvirke infektionsforløbet. Kredit:Alex Evilevitch og Ting Liu En ny unde -
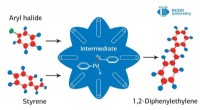 Kemiker udvikler blomsterlignende katalysatorer fra grafenKredit:RUDN University En RUDN -kemiker og kolleger fra Iran har udviklet en ny strategi til fremstilling af hule, porøse katalysatorer til Heck -koblingsreaktionen. Disse katalysatorer er kendete
Kemiker udvikler blomsterlignende katalysatorer fra grafenKredit:RUDN University En RUDN -kemiker og kolleger fra Iran har udviklet en ny strategi til fremstilling af hule, porøse katalysatorer til Heck -koblingsreaktionen. Disse katalysatorer er kendete -
 Hvor meget gryde i den brownie? Chokolade kan afvise testsI denne fredag, 16. august, 2019, Foto, kemiker David Dawson holder et hætteglas op med en ekstraheret chokoladebar, der er inficeret med cannabis, da han demonstrerer test for THC og andre kemikalier
Hvor meget gryde i den brownie? Chokolade kan afvise testsI denne fredag, 16. august, 2019, Foto, kemiker David Dawson holder et hætteglas op med en ekstraheret chokoladebar, der er inficeret med cannabis, da han demonstrerer test for THC og andre kemikalier -
 Justerbare omvendte fotokromer i fast tilstandKredit:ICN2 Fotokrome er farvestoffer, der ændrer deres farve afhængigt af det lys, de modtager. Når lyset er slukket, kan de enten forblive i deres fotoinducerede tilstand (P-type fotokromer) ell
Justerbare omvendte fotokromer i fast tilstandKredit:ICN2 Fotokrome er farvestoffer, der ændrer deres farve afhængigt af det lys, de modtager. Når lyset er slukket, kan de enten forblive i deres fotoinducerede tilstand (P-type fotokromer) ell


