Hvad er beviset for et skift i ligevægt, når ammoniumchlorid blev tilsat til stamopløsning hydroxid -phenolphthalein?
1. Den kemiske reaktion:
* ammoniumchlorid (NH₄CL) hydrolyse: Når ammoniumchlorid opløses i vand, gennemgår det hydrolyse. Dette betyder, at ammoniumionen (NH₄⁺) reagerer med vand for at producere hydroniumioner (H₃O⁺) og ammoniak (NH₃):
`` `
NH₄⁺ (aq) + H₂O (L) ⇌ H₃O⁺ (aq) + NH₃ (aq)
`` `
* Effekten på pH: Produktionen af hydroniumioner (H₃O⁺) øger surhedsgraden af opløsningen og sænker pH.
* natriumhydroxid (NaOH) og phenolphthalein: Phenolphthalein er en pH -indikator, der bliver lyserød i basale opløsninger og er farveløse i sure opløsninger. Tilstedeværelsen af NaOH gør den indledende løsning grundlæggende og drejer phenolphthalein -lyserød.
2. Skiftet i ligevægt:
* le Chateliers princip: Når en stress påføres et system i ligevægt, skifter systemet i en retning, der lindrer stresset. I dette tilfælde er tilføjelsen af NH₄CL stresset.
* skift til venstre: Tilsætningen af NH₄CL øger koncentrationen af NH₄⁺ioner. For at lindre denne stress skifter ligevægten til venstre og favoriserer dannelsen af NH₄⁺ og H₂O og forbruger H₃O⁺ og NH₃.
* faldende pH: Forbruget af H₃O⁺ -ioner gør opløsningen mindre sur, hvilket reducerer pH.
3. Observerbar bevis:
* farveændring: Efterhånden som pH falder, vil opløsningen blive mindre grundlæggende og til sidst sur. Dette vil få den lyserøde farve på phenolphthalein til at falme og til sidst forsvinde.
* Temperaturændring: Reaktionen af NH₄⁺ med vand er eksoterm. Skiftet i ligevægt mod reaktanterne (NH₄⁺ og H₂O) frigiver varme, hvilket muligvis resulterer i en lille temperaturstigning.
Kortfattet:
Tilsætningen af ammoniumchlorid til en opløsning af natriumhydroxid og phenolphthalein forårsager et skift i ligevægt. Dette skift resulterer i et fald i pH, der er beviset ved falmning af den lyserøde farve på phenolphthalein. Skiftet er drevet af Le Chateliers princip, da systemet forsøger at lindre stresset af tilsatte ammoniumioner.
Sidste artikelKan du liste 2 egenskaber ved en væske?
Næste artikelVed O -grader er Celsius eller 273K nitrogen en fast gas?
 Varme artikler
Varme artikler
-
 Hvor farlig er mikroplast?Mikroskopisk billede af en vandloppe (Daphnia magna) og Raman mikroskopisk analyse af et segment (grøn ramme i venstre billede) i dyrets tarm. De magentafarvede områder i det højre billede viser PVC-p
Hvor farlig er mikroplast?Mikroskopisk billede af en vandloppe (Daphnia magna) og Raman mikroskopisk analyse af et segment (grøn ramme i venstre billede) i dyrets tarm. De magentafarvede områder i det højre billede viser PVC-p -
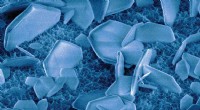 Vand spiller en uventet rolle i dannelsen af mineralerZinkoxidnanopartikler suspenderet i vand klikker sammen, når de er korrekt justeret og danner større krystaller (vist her). Kræfterne mellem partiklerne langs en specifik fastgørelsesretning blev målt
Vand spiller en uventet rolle i dannelsen af mineralerZinkoxidnanopartikler suspenderet i vand klikker sammen, når de er korrekt justeret og danner større krystaller (vist her). Kræfterne mellem partiklerne langs en specifik fastgørelsesretning blev målt -
 Nyt gennembrud inden for nanoteknologi, der bruger atmosfærisk kulstof til at fremstille nyttige ke…Fra venstre, en blanding af gasser, inklusive CO2 (rød og grå), N2 (blå), og H2 (hvid) er udsat for den nanoporøse metal-organiske ramme designet af Johnson-gruppen. Kun CO2 og H2 kommer ind i MOF, so
Nyt gennembrud inden for nanoteknologi, der bruger atmosfærisk kulstof til at fremstille nyttige ke…Fra venstre, en blanding af gasser, inklusive CO2 (rød og grå), N2 (blå), og H2 (hvid) er udsat for den nanoporøse metal-organiske ramme designet af Johnson-gruppen. Kun CO2 og H2 kommer ind i MOF, so -
 Undersøger virkningerne af fugt og tørring på cementEt nærbillede af porennetværket til en prøve af cement. Kredit:Katerina Ioannidou, et al Selvom det bruges til at konstruere nogle af verdens største strukturer, det viser sig, at cement faktisk h
Undersøger virkningerne af fugt og tørring på cementEt nærbillede af porennetværket til en prøve af cement. Kredit:Katerina Ioannidou, et al Selvom det bruges til at konstruere nogle af verdens største strukturer, det viser sig, at cement faktisk h
- Ved fremstillingen af aspirinvand tilsættes reaktionskolbe hvorfor?
- Karakteristika for Arid Climates
- Momentumet før en kollision af tre objekter er altid større end efter sand eller falsk?
- Maestro:et nyt angreb, der orkestrerer ondsindede flows med BGP
- Når tilsætning af varme, hvad ændrer det en væske til?
- Hvad er kloratomer i stratosfæren?


