Hvorfor er entalpien af dannelse benzen endotermisk?
Her er hvorfor:
* benzen er et meget stabilt molekyle. De delokaliserede elektroner i benzenringen skaber en resonansstruktur, der bidrager til dens stabilitet.
* Entalpien af dannelsen er varmeændringen, når en mol af en forbindelse dannes fra dens elementer i deres standardtilstande. I tilfælde af benzen er standardtilstandene fast kulstof (grafit) og gasformigt brint.
* dannelsen af benzen frigiver energi, hvilket indikerer en eksoterm proces. Denne energifrigivelse skyldes dannelsen af stærke C-C- og C-H-bindinger i benzenmolekylet, som mere end kompenserer for den energi, der er nødvendig for at bryde bindingerne i reaktanterne (grafit og brint).
Derfor er entalpien af dannelse af benzen negativ, hvilket indikerer en eksoterm reaktion.
Det er vigtigt at bemærke, at selvom entalpien af dannelse af benzen er eksoterm, er forbrændingen af benzen meget eksoterm. Dette skyldes, at forbrændingsprocessen involverer at bryde stærke C-C- og C-H-bindinger og danne svagere bindinger med ilt, hvilket frigiver en betydelig mængde energi.
 Varme artikler
Varme artikler
-
 Hvordan en bakterie kan hjælpe med at løse plastikforureningskrisenI. sakaiensis dyrket på poly (ethylenterephthalat) (PET) akkumulerer poly (3-hydroxybutyrat) (PHB). Kredit:Shosuke Yoshida Plastforurening er et af de mest presserende miljøspørgsmål i vores tid.
Hvordan en bakterie kan hjælpe med at løse plastikforureningskrisenI. sakaiensis dyrket på poly (ethylenterephthalat) (PET) akkumulerer poly (3-hydroxybutyrat) (PHB). Kredit:Shosuke Yoshida Plastforurening er et af de mest presserende miljøspørgsmål i vores tid. -
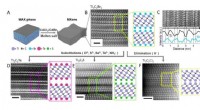 En ny strategi til syntetisering af 2-D uorganiske materialer, der bruges i kondensatorer, batterier…Overfladereaktioner af MXener i smeltede uorganiske salte. (A) Skemaer for ætsning af MAX faser i Lewis sure smeltede salte. (B) Atomisk opløsning højvinklet ringformet mørkt felt (HAADF) billede af T
En ny strategi til syntetisering af 2-D uorganiske materialer, der bruges i kondensatorer, batterier…Overfladereaktioner af MXener i smeltede uorganiske salte. (A) Skemaer for ætsning af MAX faser i Lewis sure smeltede salte. (B) Atomisk opløsning højvinklet ringformet mørkt felt (HAADF) billede af T -
 Forstå, hvad der gør sort pigment sortKredit:CC0 Public Domain Forskere har for første gang ublandet det sorte pigment, der farver vores hud og giver bananerne deres pletter. Forskere ved Ohio State University udførte arbejdet med eu
Forstå, hvad der gør sort pigment sortKredit:CC0 Public Domain Forskere har for første gang ublandet det sorte pigment, der farver vores hud og giver bananerne deres pletter. Forskere ved Ohio State University udførte arbejdet med eu -
 Vandledninger kan spille en større rolle i cellulær funktionKredit:CC0 Public Domain Hver af vores celler er omgivet af en kompleks membran, der fungerer som en biologisk grænse, lade ioner og næringsstoffer som salt, kalium og sukker ind og ud. Beskyttern
Vandledninger kan spille en større rolle i cellulær funktionKredit:CC0 Public Domain Hver af vores celler er omgivet af en kompleks membran, der fungerer som en biologisk grænse, lade ioner og næringsstoffer som salt, kalium og sukker ind og ud. Beskyttern
- Hvad er en kraft, der trak i modsatte retninger kaldet?
- Hummingbird-robot bruger AI til snart at gå, hvor droner ikke kan
- Hvad beskriver bedst produktet af transkription?
- Spin-galvanisk effekt i grafen med topologisk topping påvist
- Kvantificering af ændringer i overfladekemi af træplanter under mikrobiel gæring
- Hvordan adskiller sig Veiws of Science and Church?


