Hvor mange valenselektroner ønsker brom?
Her er hvorfor:
* Bromes position: Brom er i gruppe 17 (også kendt som VIIA) af den periodiske tabel.
* Valenselektroner: Gruppe 17 elementer har 7 valenselektroner.
* octet regel: Atomer har en tendens til at vinde, miste eller dele elektroner for at opnå en stabil konfiguration af 8 valenselektroner (som de ædle gasser).
Derfor har brom har brug for endnu en elektron for at afslutte sin oktet og opnå en stabil elektronisk konfiguration. Det opnår dette ved at danne en enkelt kovalent binding eller få et elektron til dannelse af en anion (br⁻).
 Varme artikler
Varme artikler
-
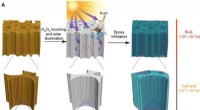 En ny måde at gøre træ gennemsigtigt på, stærkere og lettere end glasSkematisk illustration af fremstilling af gennemsigtigt træ og demonstration af dets mønstre. (A) Skematisk illustration af denne enkle, men effektive, miljøvenlig, skalerbar, og billig metode til fre
En ny måde at gøre træ gennemsigtigt på, stærkere og lettere end glasSkematisk illustration af fremstilling af gennemsigtigt træ og demonstration af dets mønstre. (A) Skematisk illustration af denne enkle, men effektive, miljøvenlig, skalerbar, og billig metode til fre -
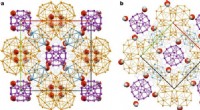 To Frank-Kasper faser i saltkrystalstrukturer observereten, Fase 1. b, Fase 2. Klynger A1, A2, B og C er farvet i lilla, orange, blå og grå, henholdsvis. I begge strukturer, lidelse er blevet fjernet for klarhedens skyld. Chlorider er blevet forbundet for
To Frank-Kasper faser i saltkrystalstrukturer observereten, Fase 1. b, Fase 2. Klynger A1, A2, B og C er farvet i lilla, orange, blå og grå, henholdsvis. I begge strukturer, lidelse er blevet fjernet for klarhedens skyld. Chlorider er blevet forbundet for -
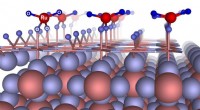 Forskere forklarer pseudocapacitansfænomenet i superkondensatorerKredit:Skoltech Forskere i Rusland og Armenien har forudsagt en ny overfladerekonstruktion af RuO 2 det forklarer oprindelsen af ladningslagring i superkondensatorer. Miniaturiseringen af el
Forskere forklarer pseudocapacitansfænomenet i superkondensatorerKredit:Skoltech Forskere i Rusland og Armenien har forudsagt en ny overfladerekonstruktion af RuO 2 det forklarer oprindelsen af ladningslagring i superkondensatorer. Miniaturiseringen af el -
 Enhedsopdatering muliggør mobiltest for vira, bakterier og aktive toksinerSandia National Laboratories kemiker Chung-Yan Koh, venstre, og tidligere Sandia bioingeniør Chris Phaneuf, ret, behold den nyligt opdaterede SpinDx diagnostiske enhed. Kredit:Jules Bernstein Du s
Enhedsopdatering muliggør mobiltest for vira, bakterier og aktive toksinerSandia National Laboratories kemiker Chung-Yan Koh, venstre, og tidligere Sandia bioingeniør Chris Phaneuf, ret, behold den nyligt opdaterede SpinDx diagnostiske enhed. Kredit:Jules Bernstein Du s
- En almindelig parasit kunne levere medicin til hjernen - hvordan forskerne gør Toxoplasma gondii fr…
- Når lysbølgen ændrer sit medium fra tæt til sjælden stiger eller falder frekvensen?
- Hvilken type binding findes mellem et atomkulstof og fluor?
- Hvad sker der under Yellowstone-vulkanen?
- Hvad er vanddamp lavet af?
- Hvilken slags energi, som en bold, der sidder på trin, har?


