Hvor mange mol NH3 kan produceres ved reaktionen 2,00 G N2 med 3,00 H2 -reaktion N2 (G) plus 3 H2 (G) 2 NH3 (G)?
1. Konverter gram til mol:
* nitrogen (N2):
- Molmasse på N2 =28,02 g/mol
- mol N2 =(2,00 g) / (28,02 g / mol) =0,0714 mol
* brint (H2):
- Molmasse H2 =2,02 g/mol
- mol H2 =(3,00 g) / (2,02 g / mol) =1,49 mol
2. Bestem den begrænsende reaktant:
* Den afbalancerede ligning viser, at 1 mol N2 reagerer med 3 mol H2.
* Vi har 0,0714 mol N2, hvilket kræver 3 * 0,0714 =0,214 mol H2.
* Da vi har mere end nok H2 (1,49 mol), er N2 den begrænsende reaktant.
3. Beregn mol af NH3 produceret:
* Den afbalancerede ligning viser, at 1 mol N2 producerer 2 mol NH3.
* Mol nh3 produceret =0,0714 mol N2 * (2 mol NH3 / 1 mol N2) =0,143 mol NH3
Derfor kan 0,143 mol NH3 produceres.
Sidste artikelHvilke elementer oxideres, og hvilket element reducerede N2 H2-NH3?
Næste artikelHvor mange valenselektroner ønsker brom?
 Varme artikler
Varme artikler
-
 Forskere undersøger 3-D-printede legeringer med høj entropiGrafisk abstrakt. Kredit: Journal of Alloys and Compounds (2021). DOI:10.1016/j.jallcom.2021.158609 Forskere fra Skoltech Center for Design, Manufacturing and Materials (CDMM) og Institute for Me
Forskere undersøger 3-D-printede legeringer med høj entropiGrafisk abstrakt. Kredit: Journal of Alloys and Compounds (2021). DOI:10.1016/j.jallcom.2021.158609 Forskere fra Skoltech Center for Design, Manufacturing and Materials (CDMM) og Institute for Me -
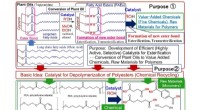 En højtydende katalysator, der opløser polyester og realiserer kemisk genbrugKatalysatorudvikling ikke kun til effektiv omdannelse af planteolier (FAEer) til værditilvækstkemikalier (finkemikalier) og råmaterialer til polymerer, men også til effektiv depolymerisering (kemisk g
En højtydende katalysator, der opløser polyester og realiserer kemisk genbrugKatalysatorudvikling ikke kun til effektiv omdannelse af planteolier (FAEer) til værditilvækstkemikalier (finkemikalier) og råmaterialer til polymerer, men også til effektiv depolymerisering (kemisk g -
 Fiskeri efter en dårlig celle ud af billioner af godeWei Li. Kredit:Texas Tech University Kræftceller kan bryde væk fra en tumor og cirkulere gennem blodet. Der er få af kræftcellerne sammenlignet med billioner af blodlegemer. Nuværende metoder til
Fiskeri efter en dårlig celle ud af billioner af godeWei Li. Kredit:Texas Tech University Kræftceller kan bryde væk fra en tumor og cirkulere gennem blodet. Der er få af kræftcellerne sammenlignet med billioner af blodlegemer. Nuværende metoder til -
 Tegn-selv-elektroder sat til at fremskynde udviklingen af mikrodetektionsenhederEn Iron-Man-formet elektrode trykt ved hjælp af teknikken. Kredit:Imperial College London Miniatureanordninger til sansning af biologiske molekyler kunne udvikles hurtigere takket være en hurtig p
Tegn-selv-elektroder sat til at fremskynde udviklingen af mikrodetektionsenhederEn Iron-Man-formet elektrode trykt ved hjælp af teknikken. Kredit:Imperial College London Miniatureanordninger til sansning af biologiske molekyler kunne udvikles hurtigere takket være en hurtig p
- Zooplankton modstandsdygtig over for langvarig opvarmning
- Ekspert forklarer, hvordan byer kan slå varmen ved at bygge bedre
- Hvad er den type mekaniske bølge, hvor energi kører i rette vinkler til at vinke?
- Trump -administrationen udhuler EPA's videnskabsintegritetskort
- Forskere ser vej til kvanteberegning ved stuetemperatur
- Forklarer:Hvad er 4-D-print?


