Hvor mange mol calciumoxid produceres, når 36,5 g reagerer fuldstændigt med iltgas?
1. Skriv den afbalancerede kemiske ligning:
Reaktionen mellem calcium (Ca) og ilt (O₂) producerer calciumoxid (CAO):
2 CA + O₂ → 2 CAO
2. Beregn den molære masse af calciumoxid (CAO):
* CA:40,08 g/mol
* O:16,00 g/mol
* CAO:40.08 + 16.00 =56,08 g/mol
3. Konverter massen af calcium til mol:
* Mol Ca =(masse af Ca) / (molmasse af Ca)
* Mol Ca =36,5 g / 40,08 g / mol =0,911 mol
4. Brug molforholdet fra den afbalancerede ligning:
Den afbalancerede ligning viser, at 2 mol Ca reagerer på producerer 2 mol Cao. Dette betyder, at molforholdet mellem Ca og Cao er 1:1.
5. Beregn molen for produceret calciumoxid:
Da molforholdet er 1:1, er antallet af mol produceret CAO lig med antallet af mol reagerede.
* Mol Cao =0,911 mol
Svar: 0,911 mol calciumoxid produceres, når 36,5 g calcium reagerer fuldstændigt med iltgas.
Sidste artikelHvad har en berylliumion og neonatom til fælles?
Næste artikelHvad sker der, når du blander en syre med et metaloxid?
 Varme artikler
Varme artikler
-
 Ingeniører kan opdage ultra sjældne proteiner i blodet ved hjælp af et mobiltelefonkameraForskernes detektionssystem bruger et standard mobiltelefonkamera til at optage video af mikrodråber, når de passerer linsen. Fluorescerende markører kan identificeres individuelt ved at matche dem me
Ingeniører kan opdage ultra sjældne proteiner i blodet ved hjælp af et mobiltelefonkameraForskernes detektionssystem bruger et standard mobiltelefonkamera til at optage video af mikrodråber, når de passerer linsen. Fluorescerende markører kan identificeres individuelt ved at matche dem me -
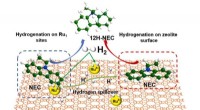 Synergistiske katalysatorer til højeffektiv brintlagringGrafisk abstrakt. Kredit:Anvendt katalyse B:Miljø (2022). DOI:10.1016/j.apcatb.2022.121958 Brintenergi betragtes som lovende vedvarende energi. Udviklingen af brintenergi er imidlertid begrænset
Synergistiske katalysatorer til højeffektiv brintlagringGrafisk abstrakt. Kredit:Anvendt katalyse B:Miljø (2022). DOI:10.1016/j.apcatb.2022.121958 Brintenergi betragtes som lovende vedvarende energi. Udviklingen af brintenergi er imidlertid begrænset -
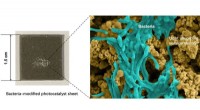 Ny teknologi omdanner sollys, vand og kuldioxid til acetat og oxygen til højværdibrændstoffer og …Fotokatalysatorark indeholdende lysabsorberende partikler og bakterier. Kredit:Northumbria University Forskere har skabt en ny teknologi, der kan hjælpe med at tackle klimaændringer og adressere de
Ny teknologi omdanner sollys, vand og kuldioxid til acetat og oxygen til højværdibrændstoffer og …Fotokatalysatorark indeholdende lysabsorberende partikler og bakterier. Kredit:Northumbria University Forskere har skabt en ny teknologi, der kan hjælpe med at tackle klimaændringer og adressere de -
 Meget selektivt adsorberende materiale tiltrækker uønskede materialer til gavn for biofremstillingEZ Select demonstrerer superhydrofobe egenskaber ved at afvise en dråbe vand. Kredit:Mary Kelly og Claire Kohout, Argonne National Laboratory En skummende stout, et solidt brød, en skarp ost; hver
Meget selektivt adsorberende materiale tiltrækker uønskede materialer til gavn for biofremstillingEZ Select demonstrerer superhydrofobe egenskaber ved at afvise en dråbe vand. Kredit:Mary Kelly og Claire Kohout, Argonne National Laboratory En skummende stout, et solidt brød, en skarp ost; hver
- Hvad kan slanger lære os om ingeniørfriktion?
- E3 videospilskonference aflyst på grund af coronavirus
- Video:Hvilken af disse svampe kan dræbe dig?
- Hvad er Nikola Teslas vigtigste videnskabelige bidrag?
- Fortaler for et skift fra race-baseret til race-bevidst medicin
- Forskning ser på den hvide arbejderklasses syn på identitet, race og immigration


