Hvad er egenskaberne ved svovl?
egenskaber ved svovl:
Fysiske egenskaber:
* udseende: Gul, sprødt fast ved stuetemperatur.
* lugt: Lugtfri i sin rene form, men svovlholdige forbindelser kan have en stærk, karakteristisk lugt (f.eks. Rotten æg).
* smag: Smagløs.
* densitet: 2,07 g/cm³ (ved stuetemperatur).
* smeltepunkt: 115,21 ° C (239,38 ° F).
* kogepunkt: 444,6 ° C (832,3 ° F).
* opløselighed: Uopløselig i vand, men opløselig i kulstofdisulfid og nogle organiske opløsningsmidler.
* krystalstruktur: Svovl kan eksistere i forskellige allotropiske former, hvor den mest almindelige er rhombisk svovl.
Kemiske egenskaber:
* reaktivitet: Svovl er et relativt ureaktivt element ved stuetemperatur, men bliver mere reaktiv ved højere temperaturer.
* Oxidation siger: Svovl kan udvise oxidationstilstande, der spænder fra -2 til +6.
* forbrænding: Svovl forbrænder i luft til dannelse af svovldioxid (SO2), en farveløs gas med en skarp lugt.
* reaktion med metaller: Svovl reagerer med de fleste metaller for at danne sulfider.
* reaktion med ikke -metaller: Svovl kan reagere med ikke -metaller som ilt, halogener og fosfor.
* surhed: Svovldioxid og svovlsyre er sure forbindelser.
* Biogeokemisk cykling: Svovl spiller en afgørende rolle i svovlcyklussen, som involverer transformation af svovl gennem forskellige oxidationstilstande.
Andre bemærkelsesværdige egenskaber:
* allotropes: Svovl findes i adskillige allotropiske former, herunder rhombisk, monoklinisk og plastisk svovl.
* isotoper: Svovl har flere isotoper, hvor den mest rigelige er 32s.
* applikationer: Svovl har adskillige anvendelser, herunder produktion af svovlsyre, gødning, gummi og farmaceutiske stoffer.
* toksicitet: Svovldioxid og svovlsyre er henholdsvis giftige gasser og væsker.
Sammendrag:
Svovl er et ikke-metallisk element med et unikt sæt fysiske og kemiske egenskaber. Det findes i forskellige former, er en nøglekomponent i flere vigtige industrielle processer og spiller en vigtig rolle i biogeokemiske cyklusser.
Sidste artikelDanner natrium og neon en ionisk forbindelse?
Næste artikelHvordan er nogle vandmasser i stand til at udligne sur nedbør?
 Varme artikler
Varme artikler
-
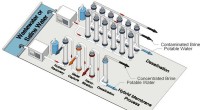 Membran kan bedre behandle spildevand, genvinde værdifulde ressourcerForskere foreslår, at nuværende afsaltningsprocesser og fremtidige hybride bruger en blokpolymermembran til at behandle ukonventionelle vandkilder. Kredit:University of Notre Dame billede/Yizhou Zhang
Membran kan bedre behandle spildevand, genvinde værdifulde ressourcerForskere foreslår, at nuværende afsaltningsprocesser og fremtidige hybride bruger en blokpolymermembran til at behandle ukonventionelle vandkilder. Kredit:University of Notre Dame billede/Yizhou Zhang -
 Dekontaminering af industrielt plastikaffald for at lette planeternes byrdeKredit:Sofi_Design, Shutterstock Med Europas ambitiøse strategi for plastgenbrug og voksende offentlig bevidsthed, en plastikforureningsfri fremtid synes mere og mere mulig på trods af nuværende f
Dekontaminering af industrielt plastikaffald for at lette planeternes byrdeKredit:Sofi_Design, Shutterstock Med Europas ambitiøse strategi for plastgenbrug og voksende offentlig bevidsthed, en plastikforureningsfri fremtid synes mere og mere mulig på trods af nuværende f -
 Ny biosensor designet til at detektere toksiner og merePEGASUS, den bærbare udviklede analytiske sensor med automatiseret prøveudtagning, er en miniaturiseret bølgeleder-baseret optisk sensor, der kan detektere toksiner, bakterielle signaturer, virale sig
Ny biosensor designet til at detektere toksiner og merePEGASUS, den bærbare udviklede analytiske sensor med automatiseret prøveudtagning, er en miniaturiseret bølgeleder-baseret optisk sensor, der kan detektere toksiner, bakterielle signaturer, virale sig -
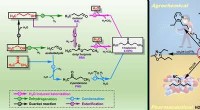 Forskere fremmer biomassetransformationsprocessen(A) Dette er en foreslået reaktionsvej, der fører til 4-HPO. (B) Dette er 4-HPO-udnyttelse. Kredit:DICP Biomasse kan tjene som en vedvarende kilde til både energi og kulstof. Acetone, n-butanol, o
Forskere fremmer biomassetransformationsprocessen(A) Dette er en foreslået reaktionsvej, der fører til 4-HPO. (B) Dette er 4-HPO-udnyttelse. Kredit:DICP Biomasse kan tjene som en vedvarende kilde til både energi og kulstof. Acetone, n-butanol, o
- Hvad er den proces, hvorved væske ændres til faste stoffer?
- Problemer med 3 kropsproblemer? Eksperter diskuterer fysik, matematik bag hit Netflix-show
- Hvilke apparater i dit hjem omdanner elektricitet til bevægelse?
- Hvor mange NO2 AWG THHN -ledninger passer ind i en 1 -ledning?
- Bærer noget mørkt stof en elektrisk ladning?
- Er den energi, som et objekt har på grund af sin bevægelse eller position?


