Hvorfor er gasser mere komprimerbare end væsker eller faste stoffer?
* afstand: I gasser er molekylerne langt fra hinanden og har svage attraktive kræfter mellem dem. Dette betyder, at der er en masse tom plads mellem molekylerne.
* Bevægelse: Gasmolekyler bevæger sig hurtigt og tilfældigt og kolliderer konstant med hinanden og væggene i deres beholder.
* Komprimering: Når trykket påføres en gas, skubbes molekylerne tættere sammen, hvilket reducerer det tomme rum. Dette er grunden til, at gasser kan komprimeres markant.
I modsætning hertil:
* væsker: Væsker har molekyler, der er tættere på hinanden end gasmolekyler, men de har stadig en vis plads mellem dem. Mens væsker er noget komprimerbare, gør molekylernes nærhed af molekylerne meget mindre komprimerbare end gasser.
* faste stoffer: Faststoffer har tæt pakket molekyler med stærke attraktive kræfter mellem dem. Der er meget lidt plads mellem molekylerne, hvilket gør faste stoffer ekstremt vanskelige at komprimere.
Kortfattet: Kompressibiliteten af et stof er direkte relateret til mængden af tomt rum mellem dets molekyler. Fordi gasser har det mest tomme rum, er de de mest komprimerbare.
 Varme artikler
Varme artikler
-
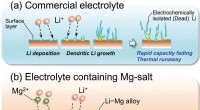 Forskere tager skridt mod sikrere batterier ved at trimme litiumgreneSkematisk illustration af den foreslåede undertrykkende effekt af Li dendritisk vækst ved tilsætning af Mg-salt. Kredit:Royal Society of Chemistry Et samarbejdende team af forskere fra Shinshu Uni
Forskere tager skridt mod sikrere batterier ved at trimme litiumgreneSkematisk illustration af den foreslåede undertrykkende effekt af Li dendritisk vækst ved tilsætning af Mg-salt. Kredit:Royal Society of Chemistry Et samarbejdende team af forskere fra Shinshu Uni -
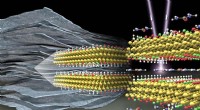 Hurtig og rasende:Ny klasse af 2D-materialer lagrer elektrisk energiMXener er 2D-materialer, der danner flerlagspartikler (venstre), som pseudokondensatorer er lavet af. Skinnende røntgenlys på MXener afslørede ændringer i deres kemiske struktur ved interkalation af u
Hurtig og rasende:Ny klasse af 2D-materialer lagrer elektrisk energiMXener er 2D-materialer, der danner flerlagspartikler (venstre), som pseudokondensatorer er lavet af. Skinnende røntgenlys på MXener afslørede ændringer i deres kemiske struktur ved interkalation af u -
 Metaller påvirker C-peptidhormon relateret til insulinUC Davis kemiker Marie Heffern er banebrydende på et nyt felt, metalloendokrinologi, at udforske, hvordan metaller som jern, zink og kobber påvirker hormoner. Kredit:Gregory Urquiaga/UC Davis Meta
Metaller påvirker C-peptidhormon relateret til insulinUC Davis kemiker Marie Heffern er banebrydende på et nyt felt, metalloendokrinologi, at udforske, hvordan metaller som jern, zink og kobber påvirker hormoner. Kredit:Gregory Urquiaga/UC Davis Meta -
 Kemisk net kan være nøglen til at fange rent brintDe lagdelte, porøs struktur af MXene, kombineret med dens kemiske sammensætning muliggør dens exceptionelle gasseparationsevner. Kredit:Drexel University Brint er et af de mest udbredte grundstoff
Kemisk net kan være nøglen til at fange rent brintDe lagdelte, porøs struktur af MXene, kombineret med dens kemiske sammensætning muliggør dens exceptionelle gasseparationsevner. Kredit:Drexel University Brint er et af de mest udbredte grundstoff
- Hvorfor beskrives baser ofte som modsatte af syrer?
- Er radius en kort knogle?
- Kan pH være negativ hvorfor eller ej?
- Ny forskning for at udforske teknologi, der er nødvendig for peer-to-peer fri handel med overskyden…
- Umulig forskning producerer 400 års El Nino rekord, afslører overraskende ændringer
- Dendrimer-teknologi får fat i celleproteiner, kunne forbedre kræftbehandlingen


