Hvorfor beskrives baser ofte som modsatte af syrer?
Her er grunden til, at de betragtes som modsætninger:
* Protonoverførsel: Når en syre og en base reagerer, donerer syren en proton (H+) til basen. Denne overførsel af en proton er den grundlæggende egenskab ved syre-base-reaktioner.
* neutralisering: Reaktionen mellem en syre og en base resulterer i dannelsen af vand (H2O) og et salt. Denne reaktion kaldes neutralisering, fordi reaktanternes sure og basale egenskaber neutraliseres.
* ph -skala: PH -skalaen måler surhedsgraden eller grundlæggende af en opløsning. Syrer har en pH-værdi, der er lavere end 7, mens baser har en pH-værdi, der er højere end 7. Dette afspejler den modsatte karakter af deres proton-donerende og proton-acceptende evner.
for eksempel:
* saltsyre (HCL) er en stærk syre, der let donerer protoner.
* natriumhydroxid (NaOH) er en stærk base, der let accepterer protoner.
Når HCL og NaOH reagerer, donerer HCL en proton til NaOH, danner vand (H2O) og natriumchlorid (NaCl), et salt. Denne reaktion neutraliserer de sure og grundlæggende egenskaber for reaktanterne.
I resumé stammer den modsatte karakter af syrer og baser fra deres komplementære roller i protonoverførselsreaktioner, deres evne til at neutralisere hinanden og deres kontrasterende positioner på pH -skalaen.
Sidste artikelEr Zarconium et flydende fast stof eller gas?
Næste artikelNår acetyl tilslutter sig 4C -molekylet, hvad produceres der?
 Varme artikler
Varme artikler
-
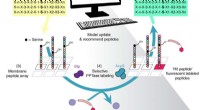 Brug af maskinlæring til at designe peptiderOversigt over den iterative Peptid Optimering med Optimal Learning (POOL) metode workflow. Kredit: Naturkommunikation (2018). DOI:10.1038/s41467-018-07717-6 Forskere og ingeniører har længe været
Brug af maskinlæring til at designe peptiderOversigt over den iterative Peptid Optimering med Optimal Learning (POOL) metode workflow. Kredit: Naturkommunikation (2018). DOI:10.1038/s41467-018-07717-6 Forskere og ingeniører har længe været -
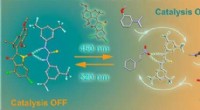 Lysstyret nanomaskine styrer katalyseSupramolekylær relæ-kontrol af organokatalyse med en hemithioindigo-baseret molekylær motor, Grafisk abstrakt. Visionen om fremtiden for miniaturisering har produceret en række syntetiske molekylæ
Lysstyret nanomaskine styrer katalyseSupramolekylær relæ-kontrol af organokatalyse med en hemithioindigo-baseret molekylær motor, Grafisk abstrakt. Visionen om fremtiden for miniaturisering har produceret en række syntetiske molekylæ -
 Elektrokemisk reduktion af kuldioxid til ethanolKredit:CC0 Public Domain NUS-forskere har opdaget en ny mekanisme til selektiv elektrokemisk reduktion af kuldioxid (CO 2 ) til ethanol under anvendelse af kobber-sølv (Cu-Ag) kompositkatalysato
Elektrokemisk reduktion af kuldioxid til ethanolKredit:CC0 Public Domain NUS-forskere har opdaget en ny mekanisme til selektiv elektrokemisk reduktion af kuldioxid (CO 2 ) til ethanol under anvendelse af kobber-sølv (Cu-Ag) kompositkatalysato -
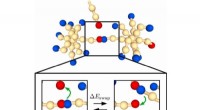 Produktion af genanvendeligt plastik et skridt nærmereDe stjerneformede polymerer bytter bindinger. Kredit:Eindhoven University of Technology En nyligt opdaget gruppe af genanvendelig plast ser ud til at være et lovende alternativ til den hårde plast
Produktion af genanvendeligt plastik et skridt nærmereDe stjerneformede polymerer bytter bindinger. Kredit:Eindhoven University of Technology En nyligt opdaget gruppe af genanvendelig plast ser ud til at være et lovende alternativ til den hårde plast
- Tror du stadig, at en asteroide dræbte dinosaurerne? Tænk om igen - ny teori tyder på
- At se hvordan planeter dannes
- Hvad hedder de to individuelle strenge hvert kromosom?
- Hvorfor sendte USA Apollo 11 til Moon?
- FN advarer om, at den caribiske vulkan kan påvirke andre øer
- Hvilket af følgende består atomer, der er bundet kovalent, mens de stadig udviser en samlet ladnin…


