Hvilket af følgende består atomer, der er bundet kovalent, mens de stadig udviser en samlet ladning?
Her er hvorfor:
* kovalente obligationer: Atomer deler elektroner for at opnå en stabil elektronkonfiguration.
* samlet afgift: Molekylet har en ubalance i antallet af protoner (positiv ladning) og elektroner (negativ ladning).
Eksempler på polyatomiske ioner:
* ammoniumion (NH₄⁺): Nitrogen- og brintatomer er kovalent bundet, men ionen har en +1 ladning på grund af tabet af et elektron.
* sulfation (so₄²⁻): Svovl og ilt er kovalent bundet, men ionen har en -2 -ladning på grund af forstærkningen af to elektroner.
* nitration (ingen₃⁻): Nitrogen og ilt er kovalent bundet, men ionen har en -1 -ladning på grund af forstærkningen af en elektron.
Nøglepunkt: Mens polyatomiske ioner har kovalente bindinger inden for deres struktur, fungerer de som en enkelt ladet enhed, når de deltager i ionisk binding med andre ioner.
Sidste artikelNår flere atomer samles, hvad er Resalte?
Næste artikelHvorfor er kobbersulfatblåt i vand?
 Varme artikler
Varme artikler
-
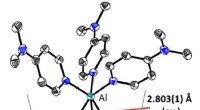 Vigtig milepæl på vejen mod overgangsmetalkatalyse med aluminiumKredit:Albert-Ludwigs-Universität Freiburg im Breisgau Kemikerne Philipp Dabringhaus, Julie Willrett og Prof. Dr. Ingo Krossing fra Institut for Uorganisk og Analytisk Kemi ved Universitetet i Frei
Vigtig milepæl på vejen mod overgangsmetalkatalyse med aluminiumKredit:Albert-Ludwigs-Universität Freiburg im Breisgau Kemikerne Philipp Dabringhaus, Julie Willrett og Prof. Dr. Ingo Krossing fra Institut for Uorganisk og Analytisk Kemi ved Universitetet i Frei -
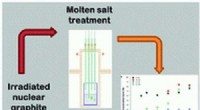 Ny behandlingsteknologi kan reducere UK nukleart affaldsbyrdeKredit:DOI:10.1039/D1EE00332A Forskere ved University of Manchester har udviklet en ny behandlingsteknologi, der kan hjælpe med at reducere Storbritanniens atomaffaldsbyrde markant. Håndteringen
Ny behandlingsteknologi kan reducere UK nukleart affaldsbyrdeKredit:DOI:10.1039/D1EE00332A Forskere ved University of Manchester har udviklet en ny behandlingsteknologi, der kan hjælpe med at reducere Storbritanniens atomaffaldsbyrde markant. Håndteringen -
 Første nogensinde in-situ måling af mekaniske egenskaber af hærdet cementmørtel på dybt havTil venstre:Måleapparat ved siden af cementmørtelprøve ved en vanddybde på ca. 3, 500 meter. Til højre:Fjernbetjent køretøj ROV Kaiko Mk-IV, bruges til at installere cementmørtelprøven. Kredit:JAMST
Første nogensinde in-situ måling af mekaniske egenskaber af hærdet cementmørtel på dybt havTil venstre:Måleapparat ved siden af cementmørtelprøve ved en vanddybde på ca. 3, 500 meter. Til højre:Fjernbetjent køretøj ROV Kaiko Mk-IV, bruges til at installere cementmørtelprøven. Kredit:JAMST -
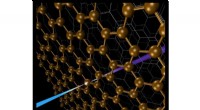 Ny sonde til hemmelighederne ved komplekse grænsefladerForskere har udtænkt en spektroskopi-metode - baseret på blød røntgen-anden-harmonisk generation - der sonderer begravede grafenlag inde i grafit. Kredit:US Department of Energy I genopladelige ba
Ny sonde til hemmelighederne ved komplekse grænsefladerForskere har udtænkt en spektroskopi-metode - baseret på blød røntgen-anden-harmonisk generation - der sonderer begravede grafenlag inde i grafit. Kredit:US Department of Energy I genopladelige ba
- Vandskelgrupper har en positiv indvirkning på lokal vandkvalitet, undersøgelse finder
- Nye træk for polymerkædedynamik
- Sådan laver du en natriumsilicatopløsning
- Få læst om lav læsefærdighedsscore
- Vandmangel og reduktion i afgrødeudbyttet på grund af klimaændringer kan reducere BNP med 10% i M…
- Bliv begejstret af neurale netværk


