Hvad er isoelektronisk med kulstof?
Forståelse af isoelektronisk
Isoelektroniske arter har det samme antal elektroner. For at finde en isoelektronisk art er vi nødt til at se på antallet af elektroner i kulstof.
Carbon's elektroner
Carbon har et atomnummer på 6, hvilket betyder, at det har 6 protoner og 6 elektroner i sin neutrale tilstand.
Find isoelektroniske arter
For at finde andre arter med 6 elektroner er vi nødt til at overveje:
* ioner: Atomer kan vinde eller miste elektroner for at blive ioner.
* Andre elementer: Andre elementer kan have det samme antal elektroner som kulstof.
Eksempler på isoelektroniske arter med kulstof:
* nitrogenion (n³⁻): Nitrogen har 7 elektroner, men når det får 3 elektroner, bliver det n³⁻ med 10 elektroner (7 + 3 =10). Dette er isoelektronisk med kulstof.
* iltion (o²⁻): Oxygen har 8 elektroner, men når det får 2 elektroner, bliver det o²⁻ med 10 elektroner (8 + 2 =10). Dette er også isoelektronisk med kulstof.
* Borion (b³⁺): Bor har 5 elektroner, men når det mister 3 elektroner, bliver det b³⁺ med 2 elektroner (5 - 3 =2). Dette er isoelektronisk med kulstof.
* neon (NE): Neon er en ædel gas med 10 elektroner. Da det har det samme antal elektroner som kulstofs isoelektroniske arter, betragtes det også som isoelektronisk med kulstof.
Key Takeaway
Mange forskellige ioner og atomer kan være isoelektronisk med kulstof. Den vigtige faktor er antallet af elektroner, ikke det specifikke element eller dets ladning.
Sidste artikelListe over nogle af de forbrændingsprodukter?
Næste artikelHvorfor bruger du CO2 gratis vand i gasabsorption?
 Varme artikler
Varme artikler
-
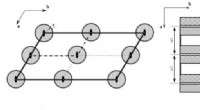 En ny klassificering af symmetrigrupper i krystalrummet foreslået af russiske videnskabsmændForbudt volumen i todimensionelle rumsymmetrigrupper:(venstre) p2 og (højre) pm. Bølget fyldning angiver forbudte områder. Kredit:Lobachevsky University Det indbyrdes arrangement af atomer i kryst
En ny klassificering af symmetrigrupper i krystalrummet foreslået af russiske videnskabsmændForbudt volumen i todimensionelle rumsymmetrigrupper:(venstre) p2 og (højre) pm. Bølget fyldning angiver forbudte områder. Kredit:Lobachevsky University Det indbyrdes arrangement af atomer i kryst -
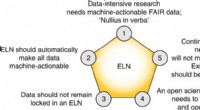 Kemisk datahåndtering:En åben vej fremDe fem kerneteser i dette perspektiv. Kredit:Nature Chemistry (2022). DOI:10.1038/s41557-022-00910-7 Et af de mest udfordrende aspekter af moderne kemi er håndtering af data. For eksempel, når de s
Kemisk datahåndtering:En åben vej fremDe fem kerneteser i dette perspektiv. Kredit:Nature Chemistry (2022). DOI:10.1038/s41557-022-00910-7 Et af de mest udfordrende aspekter af moderne kemi er håndtering af data. For eksempel, når de s -
 En fremtid med nyttige konstruerede levende maskiner?Ny blød, mekaniske metamaterialer kan tænke over, hvordan kræfter påføres det og reagere via forprogrammerede reaktioner. Kredit:Jennifer M. McCann / Elizabeth Flores-Gomez Murray, Penn State MR K
En fremtid med nyttige konstruerede levende maskiner?Ny blød, mekaniske metamaterialer kan tænke over, hvordan kræfter påføres det og reagere via forprogrammerede reaktioner. Kredit:Jennifer M. McCann / Elizabeth Flores-Gomez Murray, Penn State MR K -
 Vedvarende fotokonduktivitet bruges til at stimulere neurotypiske cellerEksponering af GaN for UV-lys forårsager en ophobning af elektroner ved den biologiske grænseflade, selv efter at lyset er fjernet. Dette fænomen, kendt som persistent fotokonduktivitet (PPC), kan bru
Vedvarende fotokonduktivitet bruges til at stimulere neurotypiske cellerEksponering af GaN for UV-lys forårsager en ophobning af elektroner ved den biologiske grænseflade, selv efter at lyset er fjernet. Dette fænomen, kendt som persistent fotokonduktivitet (PPC), kan bru
- Forskere udgiver undersøgelse om granater af sjældne jordarter
- Traditionelt Xuan-papir inspirerer til udvikling af ny gennemsigtig film med høj uklarhed
- Forskere identificerer geografiske sektorer, der kontrollerer Hadley-cirkulationen
- Hvordan omdannes ethyn til ethan?
- Hvad er ulemperne ved at have forskellige energiressourcer?
- Hvilken idé om Darwins baseret på fossiler og de moderne organismer, han fandt, siger dybest set, …


