Jern II-forbindelser danner et mørkegrønt bundfald, når natriumhydroxid tilsættes Hvorfor bliver den orange-brune venstre stående?
1. Indledende reaktion:
* Når natriumhydroxid (NaOH) tilsættes til en opløsning indeholdende jern (II) -ioner (Fe²⁺), dannes et mørkegrønt bundfald. Dette bundfald er jern (II) hydroxid (Fe (OH) ₂) .
* Reaktionen er:
Fe²⁺ (aq) + 2OH⁻ (aq) → Fe (OH) ₂ (s)
2. Oxidation:
* Jern (II) Hydroxid er ustabil i nærvær af luft (ilt).
* Oxygen fungerer som et oxidationsmiddel, hvilket får jernet (II) -ioner (Fe²⁺) til at blive oxideret til jern (III) -ioner (Fe³⁺).
* Denne oxidationsproces er langsom og sker over tid.
3. Dannelse af jern (III) Hydroxid:
* Når jern (III) -ioner dannes, reagerer de med hydroxidioner (OH⁻) for at danne jern (III) hydroxid (Fe (OH) ₃) .
* Jern (III) Hydroxid er et rødbrunt fast stof, der er ansvarlig for den observerede orangebrun farve.
Kortfattet:
* Indledende bundfald: Mark Green Fe (OH) ₂
* Oxidation: Fe²⁺ → Fe³⁺ (langsom proces)
* Endelig bundfald: Orange-Brown Fe (OH) ₃
faktorer, der påvirker oxidationshastigheden:
* ilttilgængelighed: Højere iltkoncentration fører til hurtigere oxidation.
* ph: Grundlæggende betingelser (højere pH) har en tendens til at favorisere oxidationsprocessen.
* Temperatur: Højere temperaturer øger generelt hastigheden for kemiske reaktioner, herunder oxidation.
Sidste artikelHvilken hører uran salt bor eller brint?
Næste artikelEt fosforatom omgivet af fire iltatomer kaldes ofte A?
 Varme artikler
Varme artikler
-
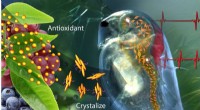 Smart antioxidantholdig polymer reagerer på kroppens kemi, miljøEt nyt lægemiddelleveringssystem, der indeholder krystalliseret catechin - en antioxidant, der findes i grøn te og frugt - kan mærke problemer og reagere ved at frigive antioxidant for at genoprette e
Smart antioxidantholdig polymer reagerer på kroppens kemi, miljøEt nyt lægemiddelleveringssystem, der indeholder krystalliseret catechin - en antioxidant, der findes i grøn te og frugt - kan mærke problemer og reagere ved at frigive antioxidant for at genoprette e -
 Hurtig 3D-print med synligt lysDette komplekse objekt blev 3D-printet på omkring 2,5 timer ved hjælp af synligt lys. Kredit:Tilpasset fra ACS Central Science 2020, DOI:10.1021/acscentsci.0c00929 3-D-print har drevet innovatio
Hurtig 3D-print med synligt lysDette komplekse objekt blev 3D-printet på omkring 2,5 timer ved hjælp af synligt lys. Kredit:Tilpasset fra ACS Central Science 2020, DOI:10.1021/acscentsci.0c00929 3-D-print har drevet innovatio -
 Optimering af effektiv perovskite solcelleanlæg(a) Energiniveau for valancebånd for perovskit (PVSK), HTL1-4 og Cu. (b) Energiniveauforskel af valancebånd for forskellige HTLer mellem PVSK/HTL og HTL/Cu. (c–f) Diagrammet over energiniveauforskelle
Optimering af effektiv perovskite solcelleanlæg(a) Energiniveau for valancebånd for perovskit (PVSK), HTL1-4 og Cu. (b) Energiniveauforskel af valancebånd for forskellige HTLer mellem PVSK/HTL og HTL/Cu. (c–f) Diagrammet over energiniveauforskelle -
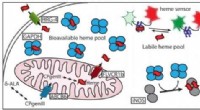 Hvordan celler håndterer en klæbrig, giftig, men absolut essentielt molekyleEt nyligt papir beskriver, hvordan hæm er chaperoneret til dets målproteiner. Kredit:Dennis Stuehr, Cleveland Clinic Nyder du at trække vejret? Du bør spare en tanke en gang imellem for heme, et j
Hvordan celler håndterer en klæbrig, giftig, men absolut essentielt molekyleEt nyligt papir beskriver, hvordan hæm er chaperoneret til dets målproteiner. Kredit:Dennis Stuehr, Cleveland Clinic Nyder du at trække vejret? Du bør spare en tanke en gang imellem for heme, et j
- Hvordan beregner du en objekter mekanisk energi?
- Molekylær skala transportør med et twist, drevet af flydende krystaldefekter
- Hvad får brugbar energi til at gå tabt, når du opvarmer dit hus?
- Hvad er overfladetemperaturen for Star Enif?
- Hvorfor skulle en ping pong -kugle gå længere med huller i den, så ingen huller?
- Hvordan tiltrækker Lightning Bugs


