Hvordan celler håndterer en klæbrig, giftig, men absolut essentielt molekyle
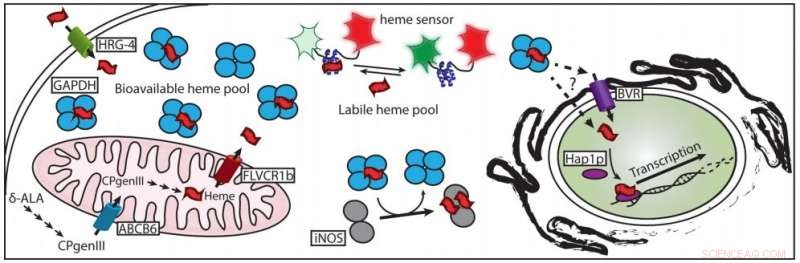
Et nyligt papir beskriver, hvordan hæm er chaperoneret til dets målproteiner. Kredit:Dennis Stuehr, Cleveland Clinic
Nyder du at trække vejret? Du bør spare en tanke en gang imellem for heme, et jernholdigt molekyle, der er afgørende for alle organismer, der er engageret i en luftåndende livsstil. Hæm-molekyler er mest kendt del af hæmoglobin, det ilttransporterende protein i blodet, men de er også komponenter i adskillige andre proteiner involveret i gastransport og fundamental kemi i celler. På egen hånd, hæm er giftig og reaktiv, men når den er spaltet korrekt ind i visse proteiner, det er helt afgørende.
Indtil for nylig, et grundlæggende mysterium om hæm forblev uløst:Hvordan kommer det fra mitokondrier, hvor det er lavet, til proteinerne i andre dele af cellen, hvor det er nødvendigt?
Et team af forskere ved Lerner Research Institute of the Cleveland Clinic har nu løst dette mangeårige puslespil ved at identificere det protein, der "chaperones" fri hæm i celler ved at binde sig til det, forhindrer det i at gøre skade på cellen, indtil det er leveret, hvor det er nødvendigt. Resultaterne er offentliggjort i Journal of Biological Chemistry .
Dennis Stuehr, efterforskeren ved Cleveland Clinic, der overvågede den nye undersøgelse, havde været interesseret i mysteriet om den ukendte hæm-chaperone i årevis. "Det var overraskende, at næsten intet var kendt, " sagde Stuehr. "I litteraturen, det ser ud til, at alle lige har slukket lyset og er gået hjem."
Lidt efter lidt, Stuehrs team har sammensat biokemien af fri hæm. Det første skridt var at finde ud af, hvilke proteiner hæm kan binde sig til. Derefter, de var nødt til at eksperimentere for at se, hvilke af de proteiner, som hæm klæber til, for at hjælpe det med at nå sin endelige destination.
"Heme er lidt klæbrig; det binder til mange ting, " sagde Elizabeth Sweeny, postdoc-stipendiaten, der var en af medlederne i det nye studie. "Dette (undersøgelse) var første gang, vi fandt et protein, der ikke kun binder hæm, og binder meget af det, men er også påkrævet for levering til nedstrøms hæmproteinmål."
Den nye undersøgelse bruger flere bevislinjer til at implicere en uventet spiller som hæmes chaperon:glyceraldehyd 3-phosphat dehydrogenase, eller GAPDH. GAPDH er et enzym, der er involveret i at nedbryde sukker i celler. Det er almindeligt, uglamorøse komponent i cellens grundlæggende stofskifte, så meget, at laboratorieforskere hovedsageligt bruger det som en grundlæggende kontrol i undersøgelser af andre proteiner.
"GAPDH er sådan en latterlig kandidat, " sagde Stuehr. "Men der har været denne nye historie om, at GAPDH ikke bare er dette kedelige glykolytiske enzym, der er i hver celle; det har disse andre roller i cellebiologi. Og hemlevering er en af disse nye roller."
GAPDH er muligvis ikke det eneste protein, der er involveret i chaperoning hæm, Stuehr tilføjer, og forskning i flere detaljer om, hvordan hæm leveres, er i gang.
"Vores fund besvarer et cellebiologiske spørgsmål, der har eksisteret i nogen tid, vedrørende leveringsmekanismen for dette essentielle biomolekyle, " sagde Stuehr. "Nu kan vi tænke over og undersøge, hvordan forstyrrelse af denne leveringsproces faktisk kan bidrage til en række sygdomme, (som) anæmi, astma og mere."
 Varme artikler
Varme artikler
-
 Diffusion og osmose-lektionsaktiviteterDiffusion og osmose er noget vanskeligt at forstå videnskabelige begreber, der ofte bedst forklares gennem labaktiviteter. Under diffusion spredes stof på en måde, der får det til at opnå en ens konce
Diffusion og osmose-lektionsaktiviteterDiffusion og osmose er noget vanskeligt at forstå videnskabelige begreber, der ofte bedst forklares gennem labaktiviteter. Under diffusion spredes stof på en måde, der får det til at opnå en ens konce -
 Forskere beviser, at vand har flere flydende tilstandeKredit:CC0 Public Domain Vand er en allestedsnærværende væske med mange meget unikke egenskaber. Måden den reagerer på ændringer i tryk og temperatur kan være helt anderledes end andre væsker, og
Forskere beviser, at vand har flere flydende tilstandeKredit:CC0 Public Domain Vand er en allestedsnærværende væske med mange meget unikke egenskaber. Måden den reagerer på ændringer i tryk og temperatur kan være helt anderledes end andre væsker, og -
 Undersøgelse viser, at enkelte atomer kan lave mere effektive katalysatorerForskere brugte en kombination af fire teknikker, repræsenteret her af fire indkommende stråler, at afsløre i hidtil uset detalje, hvordan et enkelt atom af iridium katalyserer en kemisk reaktion. Kre
Undersøgelse viser, at enkelte atomer kan lave mere effektive katalysatorerForskere brugte en kombination af fire teknikker, repræsenteret her af fire indkommende stråler, at afsløre i hidtil uset detalje, hvordan et enkelt atom af iridium katalyserer en kemisk reaktion. Kre -
 Hvilke kemikalier bruges til at rense drikkevand?Rensning af drikkevand involverer fjernelse af forurenende stoffer fra vandkilder, der kan forårsage skade, eller som kan sætte niveauer over de føderalt foreskrevne niveauer, der er indstillet for
Hvilke kemikalier bruges til at rense drikkevand?Rensning af drikkevand involverer fjernelse af forurenende stoffer fra vandkilder, der kan forårsage skade, eller som kan sætte niveauer over de føderalt foreskrevne niveauer, der er indstillet for
- NASA får infrarød visning af Carolina Chris, den tropiske storm
- Hubble baner videnskabelige veje for James Webb Space Telescope
- Forskere udforsker ny klasse af syntetiske vacciner
- Chinas Silk Road -projekt løber ind i gældskøer
- Hawaii vulkan producerer giftig lava dis plume kaldet doven
- Sådan fungerer radiale motorer


