Når vandioniserer det producerer lige store mængder brint- og hydroxidioner, som kan forbindes med hinanden?
Vandionisering
* Processen: Vandmolekyler (H₂O) kan spontant ionisere, hvilket betyder, at de går i stykker i en hydrogenion (H⁺) og en hydroxidion (OH⁻). Denne proces er reversibel.
* Ligningen:
2H₂O (L) ⇌ H₃O⁺ (aq) + OH⁻ (aq)
(Denne ligning er ofte forenklet til H₂O (L) ⇌ H⁺ (aq) + OH⁻ (aq), men det er vigtigt at huske, at H⁺ faktisk eksisterer som hydroniumion, H₃O⁺, i opløsning)
ligevægt
* Lige beløb: I rent vand er ioniseringshastigheden lig med re-associeringshastigheden. Dette betyder, at koncentrationen af hydrogenioner (H⁺) ved ligevægt (H⁺) er lig med koncentrationen af hydroxidioner (OH⁻).
* kW: Ionproduktkonstanten for vand, KW, repræsenterer denne ligevægt:
* KW =[H⁺] [OH⁻] =1,0 x 10⁻¹⁴ ved 25 ° C
* pH og POH: PH- og POH -skalaerne er baseret på henholdsvis koncentrationen af brint- og hydroxidioner. I rent vand er pH og POH begge 7.
Betydningen af ligevægt
Denne dynamiske ligevægt er afgørende for:
* Vedligeholdelse af pH -balance: De lige koncentrationer af H⁺ og OH⁻ hjælper med at holde vandneutral.
* syre-base-reaktioner: Ændringer i koncentrationen af H⁺ eller OH⁻ kan skifte ligevægt, hvilket påvirker surhedsgraden eller alkaliniteten af en opløsning.
Nøglepunkter
* Vand ioniserer og associeres konstant.
* Ligevægten resulterer i lige store koncentrationer af H⁺ og OH⁻ i rent vand.
* Denne ligevægt er grundlæggende for at forstå syre-base-kemi.
Sidste artikelHvilken molaritet på 6 mol NaCl opløses i 2 L vand?
Næste artikelHvad ville formlen for et sammensat barium og klor være?
 Varme artikler
Varme artikler
-
 Forskere skaber en krystal i en krystal til nye elektroniske enhederForskere ved Pritzker School for Molecular Engineering ved University of Chicago annoncerer et gennembrud med blå flydende fasekrystaller, som skaber disse smukke mønstre set under et mikroskop. Kredi
Forskere skaber en krystal i en krystal til nye elektroniske enhederForskere ved Pritzker School for Molecular Engineering ved University of Chicago annoncerer et gennembrud med blå flydende fasekrystaller, som skaber disse smukke mønstre set under et mikroskop. Kredi -
 Forskere udvikler hybrid meta-biomateriale, der kan forlænge levetiden af hofteimplantater3D-printet hofteimplantat udviklet ved hjælp af det nye hybride meta-biomateriale. Kredit:TU Delft Et hybrid meta-biomateriale, der fremmer knoglevækst, er ikke noget, du finder i naturen, men det
Forskere udvikler hybrid meta-biomateriale, der kan forlænge levetiden af hofteimplantater3D-printet hofteimplantat udviklet ved hjælp af det nye hybride meta-biomateriale. Kredit:TU Delft Et hybrid meta-biomateriale, der fremmer knoglevækst, er ikke noget, du finder i naturen, men det -
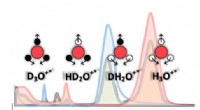 Flydende vand er mere end bare brint-ilt-molekylerInfrarøde lysspektre (rødt), tung (blå), halvtungt (grå) vand, og ioniske arter, der er blevet identificeret i den aktuelle undersøgelse. Rød, hvide og sorte cirkler viser ilt, hydrogen- og deuteriuma
Flydende vand er mere end bare brint-ilt-molekylerInfrarøde lysspektre (rødt), tung (blå), halvtungt (grå) vand, og ioniske arter, der er blevet identificeret i den aktuelle undersøgelse. Rød, hvide og sorte cirkler viser ilt, hydrogen- og deuteriuma -
 Nyt krystallinsk oxid kan løse problemet med overophedning i kompositmaterialerKredit:Toshihiro Isobe, Tokyo Institute of Technology Forskere ved Tokyo Institute of Technology har for nylig syntetiseret et nyt materiale, der viser unikke termiske ekspansionsegenskaber. Metod
Nyt krystallinsk oxid kan løse problemet med overophedning i kompositmaterialerKredit:Toshihiro Isobe, Tokyo Institute of Technology Forskere ved Tokyo Institute of Technology har for nylig syntetiseret et nyt materiale, der viser unikke termiske ekspansionsegenskaber. Metod
- Orkaner kan være op til fem gange mere sandsynlige i Caribien, hvis hårdere mål savnes
- Er mesosfæren den samme som mantel?
- Er elektricitetssager eller ikke noget?
- Hvordan påvirker en forøgelse af koncentrationen af kaliumiodid og svovlsyre reaktionshastighede…
- Gamle bævere hugger først træer til mad, ikke at bygge dæmninger
- Hvordan bruger planter næringsstoffer og vand til at producere mad eller glukose?


