Hvorfor danner klorgasgas ved den positive elektrode?
1. Oxidation ved anoden: Anoden er, hvor oxidation forekommer. Dette betyder, at elektroner går tabt fra de arter, der er til stede ved elektroden.
2. Chloridioner 'tendens til at miste elektroner: Chloridioner (Cl-) har en stærk tendens til at miste elektroner og blive kloratomer. Dette skyldes, at klor er et meget elektronegativt element, hvilket betyder, at det har en stærk attraktion for elektroner.
3. Dannelse af klorgas: Når chloridioner mister elektroner ved anoden, bliver de kloratomer. Disse kloratomer kombineres derefter med hinanden for at danne klorgas (CL2):
2Cl- → Cl2 + 2e-
overordnet proces:
Under elektrolysen af en opløsning, der indeholder chloridioner, finder følgende proces sted ved anoden:
* Chloridioner (Cl-) migrerer mod den positive anode.
* Chloridioner mister elektroner (oxidation) og bliver kloratomer.
* Kloratomer kombineres for at danne klorgas (CL2), som derefter frigøres fra opløsningen.
Kortfattet: Klorgasformer ved den positive elektrode, fordi chloridioner oxideres ved anoden, mister elektroner og danner kloratomer, der kombineres for at danne klorgas.
Sidste artikelHvorfor er kemisk forvitring hurtigere i troperne?
Næste artikelHvad binder ilt med?
 Varme artikler
Varme artikler
-
 at reducere omkostningerne til ethanol, andre biobrændstoffer og benzinEnzymer, gensplejset for at undgå at klæbe til overfladerne af biomasse såsom majsstilke, kan sænke omkostningerne ved produktion af cellulosebaserede biobrændstoffer som ethanol. Kredit:Shishir Chund
at reducere omkostningerne til ethanol, andre biobrændstoffer og benzinEnzymer, gensplejset for at undgå at klæbe til overfladerne af biomasse såsom majsstilke, kan sænke omkostningerne ved produktion af cellulosebaserede biobrændstoffer som ethanol. Kredit:Shishir Chund -
 En ny forståelse af proteinbevægelseEt team af ingeniører har vist, at overfladediffusion i proteintransport til ionbytterperler afhænger af adsorptionsaffinitet - et mål for tiltrækning mellem de to materialer. Kredit:University of Del
En ny forståelse af proteinbevægelseEt team af ingeniører har vist, at overfladediffusion i proteintransport til ionbytterperler afhænger af adsorptionsaffinitet - et mål for tiltrækning mellem de to materialer. Kredit:University of Del -
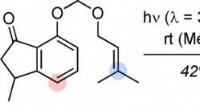 Total syntese af sesquiterpen agarozizanol BKredit:Wiley Med udgangspunkt i tilgængelige kemikalier, et tysk team af forskere gennemførte med succes den totale syntese af agarozizanol B, et interessant naturligt stof, der findes i agartræ.
Total syntese af sesquiterpen agarozizanol BKredit:Wiley Med udgangspunkt i tilgængelige kemikalier, et tysk team af forskere gennemførte med succes den totale syntese af agarozizanol B, et interessant naturligt stof, der findes i agartræ. -
 En tungvægtsløsning til lettere kampkøretøjerFriction Stir Dovetailing er en proces, der forbinder tykke plader af aluminium til stål. Den nye proces vil blive brugt til at lave lettere militærkøretøjer, der er mere adrætte og brændstofeffektive
En tungvægtsløsning til lettere kampkøretøjerFriction Stir Dovetailing er en proces, der forbinder tykke plader af aluminium til stål. Den nye proces vil blive brugt til at lave lettere militærkøretøjer, der er mere adrætte og brændstofeffektive
- Hvem opdager Celsius?
- Eksperimenter viser, at molekyler, ikke substrater, mest er ansvarlige for chiralitetsinduceret spin…
- Hvilke kræfter fungerer, når bilen bevæger sig fremad?
- Geovidenskabsfolk opdager en overset kilde til Jordens vand
- Hvad holder kraften af en bold på streng bevæger sig i cirkel?
- I en alder af 6, børn har en tendens til at se hvide mænd som mere geniale end hvide kvinder


