Hvorfor er svovl en del af gruppe 16 den periodiske tabel?
Her er hvorfor:
* Valenselektroner: Dette er elektronerne i den yderste skal af et atom, der er involveret i kemisk binding.
* gruppe 16 elementer: Alle elementer i gruppe 16 har seks valenselektroner. Denne delte egenskab er grunden til, at de er grupperet sammen.
* Svovls elektronkonfiguration: Svovl har et atomnummer på 16. Dens elektronkonfiguration er 2, 8, 6. Dette betyder, at det har 6 elektroner i sin yderste skal (den tredje skal).
Dette almindelige træk ved at have seks valenselektroner fører til lignende kemiske egenskaber for alle elementer i gruppe 16, såsom:
* tendens til at få to elektroner til dannelse af anioner med en -2 -ladning: Dette skyldes, at de er to elektroner væk fra at opnå en stabil oktetkonfiguration.
* Dannelse af kovalente forbindelser: De deler ofte elektroner med andre ikke -metaller til dannelse af kovalente bindinger.
* Oxidation siger: Mens svovl kan have forskellige oxidationstilstande, er -2 dets mest almindelige på grund af dens tendens til at få to elektroner.
Derfor afspejler svovlens placering i gruppe 16 dens delte elektroniske struktur og den resulterende kemiske opførsel med andre elementer i denne gruppe.
 Varme artikler
Varme artikler
-
 Grønt lys for en ny generation af dynamiske materialerForskere ved QUT, UGent og KIT har været banebrydende for et nyt TAD/naphthalen-baseret lysstabiliseret dynamisk materiale, der er stabilt under synligt grønt lys og bliver flydende over tid i mørke.
Grønt lys for en ny generation af dynamiske materialerForskere ved QUT, UGent og KIT har været banebrydende for et nyt TAD/naphthalen-baseret lysstabiliseret dynamisk materiale, der er stabilt under synligt grønt lys og bliver flydende over tid i mørke. -
 Små skæl kan tjene som sikkert materiale i implantater til at forstærke knogler og ledEt scanningselektronmikroskopbillede viser de kunstige skæl, ” omkring et dusin af dem kunne passe på tværs af punktum i slutningen af en sætning. Kredit:Tian lab/University of Chicago Vægt er d
Små skæl kan tjene som sikkert materiale i implantater til at forstærke knogler og ledEt scanningselektronmikroskopbillede viser de kunstige skæl, ” omkring et dusin af dem kunne passe på tværs af punktum i slutningen af en sætning. Kredit:Tian lab/University of Chicago Vægt er d -
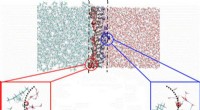 Toppe af vandige bølger kan transportere vitale kemikalier i industriel separationsprocesHvordan molekyler bevæger sig og organiserer sig i vand, når væsken møder olien, afhænger af, om kemikaliet er på toppen eller truget af en lille bølge af vand ved grænsefladen. Kredit:US Department o
Toppe af vandige bølger kan transportere vitale kemikalier i industriel separationsprocesHvordan molekyler bevæger sig og organiserer sig i vand, når væsken møder olien, afhænger af, om kemikaliet er på toppen eller truget af en lille bølge af vand ved grænsefladen. Kredit:US Department o -
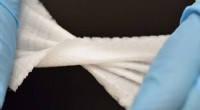 3D-trykt Biomesh minimerer brokreparationskomplikationer3D -printet Biomesh demonstrerer sin mekaniske styrke og fleksibilitet. Kredit:Baylor College of Medicine Brok er en af de mest almindelige bløde vævsskader. Brok dannes ved intra-abdominal indh
3D-trykt Biomesh minimerer brokreparationskomplikationer3D -printet Biomesh demonstrerer sin mekaniske styrke og fleksibilitet. Kredit:Baylor College of Medicine Brok er en af de mest almindelige bløde vævsskader. Brok dannes ved intra-abdominal indh
- Hvorfor tror forskere, at Mars engang var en vådere planet?
- Hvor meget plads har solcellepanelet brug for?
- Hvad er termisk ekspension?
- Forskere til globale politiske beslutningstagere:Behandl fisk som mad for at hjælpe med at løse ve…
- Diæthemmeligheder fra 'de kongelige' -- Isotoper af elefanthalehår viser kvæg ud-gnasker pachyder…
- Ved brug af avanceret mikroskopi til at nanokonstruere nye materialer til databehandling og elektron…


