Hvorfor har polære og ikke -polære molekyler forskellige egenskaber?
polære molekyler:
* ujævn fordeling af ladning: Polære molekyler har en ujævn fordeling af elektroner, hvilket resulterer i en delvis positiv (Δ+) ladning I den ene ende af molekylet og A delvis negativ (Δ-) ladning i den anden ende. Dette skyldes forskelle i elektronegativitet mellem atomerne i molekylet.
* dipolmoment: Adskillelsen af afgifter skaber et dipolmoment , et mål for molekylets polaritet.
* stærkere intermolekylære kræfter: De delvise ladninger i polære molekyler fører til stærkere dipol-dipol-interaktioner , som er attraktive kræfter mellem de positive og negative ender af de nærliggende molekyler. Disse kræfter inkluderer også hydrogenbinding , en særlig stærk type dipol-dipolinteraktion, når brint er bundet til et stærkt elektronegativt atom som ilt eller nitrogen.
* Højere smeltnings- og kogepunkter: Stærkere intermolekylære kræfter kræver mere energi til at overvinde, hvilket fører til højere smelte- og kogepunkter.
* opløselighed i polære opløsningsmidler: Polære molekyler har en tendens til at opløses i polære opløsningsmidler som vand, fordi de kan interagere med de delvise ladninger af opløsningsmiddelmolekylerne gennem dipol-dipolinteraktioner.
ikke -polære molekyler:
* Even Distribution of Charge: Ikke -polære molekyler har en jævn fordeling af elektroner, hvilket resulterer i ingen overordnet ladningsadskillelse.
* Intet dipolmoment: På grund af de jævne ladningsfordeling har ikke -polære molekyler ikke et dipolmoment.
* svagere intermolekylære kræfter: Ikke -polære molekyler oplever kun svage London -spredningskræfter , som er midlertidige, inducerede dipoler, der opstår fra bevægelsen af elektroner.
* lavere smeltnings- og kogepunkter: Svagere intermolekylære kræfter kræver mindre energi til at overvinde, hvilket resulterer i lavere smelte- og kogepunkter.
* opløselighed i ikke -polære opløsningsmidler: Ikke -polære molekyler har en tendens til at opløses i ikke -polære opløsningsmidler som olie, fordi de kan interagere med opløsningsmiddelmolekylerne gennem London -spredningskræfter.
Eksempler:
* polære molekyler: Vand (H₂O), ethanol (Ch₃ch₂oh), ammoniak (NH₃)
* ikke -polære molekyler: Metan (ch₄), kuldioxid (co₂), olie
Kortfattet: Forskellen i ladningsfordeling mellem polære og ikke -polære molekyler fører til forskellige styrker af intermolekylære kræfter, som igen bestemmer de forskellige egenskaber ved disse molekyler, herunder smeltepunkt, kogepunkt og opløselighed.
Sidste artikelHvad er holdbarheden for jernholdig sulfatopløsning?
Næste artikelVil natrium give op elektroner til andre atomer?
 Varme artikler
Varme artikler
-
 Farveændrende kontaktlinse kan forbedre overvågningen af behandlinger med øjensygdommeKontaktlinser, der skifter farve efter at have frigivet lægemidler i øjet, kan hjælpe læger med at afgøre, om en medicin bliver leveret til det tilsigtede behandlingssted. Kredit:American Chemical Soc
Farveændrende kontaktlinse kan forbedre overvågningen af behandlinger med øjensygdommeKontaktlinser, der skifter farve efter at have frigivet lægemidler i øjet, kan hjælpe læger med at afgøre, om en medicin bliver leveret til det tilsigtede behandlingssted. Kredit:American Chemical Soc -
 Manganoxidmateriale kan hurtigt lagre og frigive lavgradig varme uden at nedbrydesVarme frigives fra manganoxidmaterialet, når vandmolekyler trænger ind i dets lagdelte struktur. Kredit:Norihiko L. Okamoto Forskere i Japan har fundet et almindeligt stof, der reversibelt og hurti
Manganoxidmateriale kan hurtigt lagre og frigive lavgradig varme uden at nedbrydesVarme frigives fra manganoxidmaterialet, når vandmolekyler trænger ind i dets lagdelte struktur. Kredit:Norihiko L. Okamoto Forskere i Japan har fundet et almindeligt stof, der reversibelt og hurti -
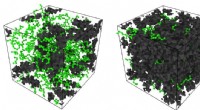 Tæt mellemrum spids tilstedeværelse af petrokemikalierSimuleringssnapshots af Rice University-ingeniører viser n-heptan-molekyler (grøn) under forskellige grader af indeslutning i en polymermatrix af molekyler (sort), hvor den højviskose polymer er en mo
Tæt mellemrum spids tilstedeværelse af petrokemikalierSimuleringssnapshots af Rice University-ingeniører viser n-heptan-molekyler (grøn) under forskellige grader af indeslutning i en polymermatrix af molekyler (sort), hvor den højviskose polymer er en mo -
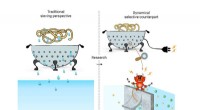 Aktiv sigtning kunne forbedre dialyse- og vandrensningsfiltreFor at adskille molekyler bruges normalt et colander-filter (venstre side). En ny type filter, hvor hullerne i sien kan aktiveres udforskes. (Højre side) Takket være en ekstern strømindgang, hullerne
Aktiv sigtning kunne forbedre dialyse- og vandrensningsfiltreFor at adskille molekyler bruges normalt et colander-filter (venstre side). En ny type filter, hvor hullerne i sien kan aktiveres udforskes. (Højre side) Takket være en ekstern strømindgang, hullerne


